
| A、+3 | B、+4 | C、+5 | D、+6 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 除去悬浮 |
| 杂质 |
| 浓缩 |
| 氧化剂 |
| 氧化 |
| 热空气 |
| Na2CO3溶液 |
| 吸收 |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤出的不溶物一定是铜 |
| B、滤出的不溶物一定含铜,但不一定含铁 |
| C、滤出的不溶物一定是铁 |
| D、滤液中一定含有Fe2+和Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2molA 1molB |
| B、1molA 1molB |
| C、1molA 2molB |
| D、1molB 1molC |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸只作催化剂. |
| B、反应温度控制在140℃左右 |
| C、用排空气法收集乙烯,收集后把集气瓶口向上放在桌子上 |
| D、为了防止混合液暴沸,在反应容器中放入几片碎瓷片 |
查看答案和解析>>
科目:高中化学 来源: 题型:

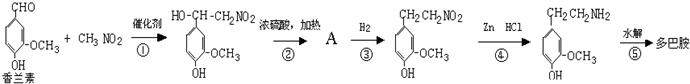 (3)多巴胺可由香兰素与硝基甲烷缩合,再经锌-盐酸还原水解而得.合成过程表示如下:
(3)多巴胺可由香兰素与硝基甲烷缩合,再经锌-盐酸还原水解而得.合成过程表示如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、属于非极性分子 |
| B、沸点低于CO2 |
C、电子式为 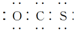 |
| D、三个原子位于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| Al2O3 | Fe2O3 | Na2O | |
| 质量分数 | 0.065 | 0.850 | 0.029 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com