
| ±ý∫≈ | µ—È≤Ÿ◊˜ | ‘§∆⁄œ÷œÛ∫ÕΩ·¬€ |
| ≤Ω÷Ë¢Ÿ | »°…Ÿ¡ø¥˝≤‚“∫º”»Î ‘πÐ÷–£¨º”»Îπ˝¡ø2mol°§L-1HCl£¨‘ŸµŒº” ¡ø1 mol°§L-1BaCl2 »Ð“∫°£ | ”–∞◊…´≥¡µÌ…˙≥…£¨÷§√˜¥˝≤‚“∫÷–∫¨”–°¢SO42- °£ |
| ≤Ω÷Ë¢⁄ | | |
| ≤Ω÷Ë¢€ | | |
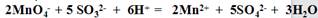
| | µ—È≤Ÿ◊˜ | ‘§∆⁄œ÷œÛ”ÎΩ·¬€ |
| ≤Ω÷Ë¢⁄ | ∑Ω∑®1£∫»°…Ÿ¡ø≤Ω÷Ë¢Ÿ÷–…œ≤„«Â“∫”⁄ ‘πÐ÷–£¨º”»Î…Ÿ¡ø¬»ÀÆ£¨π€≤ϻГ∫µƒ—’…´°££®2∑÷£©£®»Ù‘Ÿº”»ÎCCl4£¨’Òµ¥£¨æ≤÷√π€≤Ï—’…´“≤ø…£© | »Ð“∫≥ ≥»ª∆…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££®2∑÷£©£®œ¬≤„“∫ÃÂ≥ ≥»∫Ï…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££© |
| ∑Ω∑®2£∫¡Ì»°…Ÿ¡ø¥˝≤‚“∫”⁄ ‘πÐ÷–£¨º”»Î◊„¡øµƒ2 mol°§L-1—ŒÀ·÷±µΩ≤ª≤˙…˙∆¯≈ðŒ™÷𣨑Ÿº”»Î…Ÿ¡ø¬»ÀÆ£¨π€≤ϻГ∫µƒ—’…´°££®2∑÷£©£®»Ù‘Ÿº”»ÎÀƒ¬»ªØú£¨’Òµ¥£¨æ≤÷√∫Ûπ€≤Ï—’…´“≤ø…£© | »Ð“∫≥ ≥»ª∆…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££®2∑÷£©£®œ¬≤„“∫ÃÂ≥ ≥»∫Ï…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££© | |
| ≤Ω÷Ë¢€ | ∑Ω∑®1£∫»°≥ˆ≤Ω÷Ë¢Ÿ÷– ¡ø…œ≤„«Â“∫”⁄ ‘πÐ÷–£¨µŒ»Î2µŒ∆∑∫Ï£¨π€≤ϻГ∫µƒ—’…´°££®2∑÷£© | ∫Ï…´Õ »•£¨‘ڥʑ⁄SO32-£¨∫Ï…´≤ªÕ »•£¨‘Ú≤ª¥Ê‘⁄SO32-°££®2∑÷£© |
| ∑Ω∑®2£∫¡Ì»°…Ÿ¡ø¥˝≤‚“∫”⁄ ‘πÐ÷–£¨º”»Îπ˝¡ø2mol/L—ŒÀ·£¨‘ŸµŒ»Î2µŒ∆∑∫Ïπ€≤ϻГ∫µƒ—’…´°££®2∑÷£© | ∫Ï…´Õ »•£¨‘ڥʑ⁄SO32-£¨∫Ï…´≤ªÕ »•£¨‘Ú≤ª¥Ê‘⁄SO32-°££®2∑÷£© |
| | µ—È≤Ÿ◊˜ | ‘§∆⁄œ÷œÛ”ÎΩ·¬€ |
| ≤Ω÷Ë¢⁄ | ∑Ω∑®1£∫»°…Ÿ¡ø≤Ω÷Ë¢Ÿ÷–…œ≤„«Â“∫”⁄ ‘πÐ÷–£¨º”»Î…Ÿ¡ø¬»ÀÆ£¨π€≤ϻГ∫µƒ—’…´°££®2∑÷£©£®»Ù‘Ÿº”»ÎCCl4£¨’Òµ¥£¨æ≤÷√π€≤Ï—’…´“≤ø…£© | »Ð“∫≥ ≥»ª∆…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££®2∑÷£©£®œ¬≤„“∫ÃÂ≥ ≥»∫Ï…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££© |
| ∑Ω∑®2£∫¡Ì»°…Ÿ¡ø¥˝≤‚“∫”⁄ ‘πÐ÷–£¨º”»Î◊„¡øµƒ2 mol°§L-1—ŒÀ·÷±µΩ≤ª≤˙…˙∆¯≈ðŒ™÷𣨑Ÿº”»Î…Ÿ¡ø¬»ÀÆ£¨π€≤ϻГ∫µƒ—’…´°££®2∑÷£©£®»Ù‘Ÿº”»ÎÀƒ¬»ªØú£¨’Òµ¥£¨æ≤÷√∫Ûπ€≤Ï—’…´“≤ø…£© | »Ð“∫≥ ≥»ª∆…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££®2∑÷£©£®œ¬≤„“∫ÃÂ≥ ≥»∫Ï…´£¨÷§√˜¥˝≤‚“∫÷–∫¨Br-°££© | |
| ≤Ω÷Ë¢€ | ∑Ω∑®1£∫»°≥ˆ≤Ω÷Ë¢Ÿ÷– ¡ø…œ≤„«Â“∫”⁄ ‘πÐ÷–£¨µŒ»Î2µŒ∆∑∫Ï£¨π€≤ϻГ∫µƒ—’…´°££®2∑÷£© | ∫Ï…´Õ »•£¨‘ڥʑ⁄SO32-£¨∫Ï…´≤ªÕ »•£¨‘Ú≤ª¥Ê‘⁄SO32-°££®2∑÷£© |
| ∑Ω∑®2£∫¡Ì»°…Ÿ¡ø¥˝≤‚“∫”⁄ ‘πÐ÷–£¨º”»Îπ˝¡ø2mol/L—ŒÀ·£¨‘ŸµŒ»Î2µŒ∆∑∫Ïπ€≤ϻГ∫µƒ—’…´°££®2∑÷£© | ∫Ï…´Õ »•£¨‘ڥʑ⁄SO32-£¨∫Ï…´≤ªÕ »•£¨‘Ú≤ª¥Ê‘⁄SO32-°££®2∑÷£© |


 ‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
‘ƒ∂¡øÏ≥µœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫µ•—°Ã‚
| A£ÆΩ Ù–‚ ¥ | B£Æ∫£ÀÆ…π—Œ | C£Æ ≥ŒÔ∏Ø∞Ð | D£Æ»º∑≈±Þ≈⁄ |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫ÃÓø’Â
 Cu +H2O
Cu +H2O 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O| A£Æ «—ıªØº¡ |
| B£Æ «ªπ‘≠º¡ |
| C£Æº» «—ıªØº¡”÷ «ªπ‘≠º¡ |
| D£Æº»≤ª «—ıªØº¡”÷≤ª «ªπ‘≠º¡ |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫µ•—°Ã‚
| A£Æº»≤ª «—ıªØº¡“≤≤ª «ªπ‘≠º¡ | B£Æ «—ıªØº¡ |
| C£Æ «ªπ‘≠º¡ | D£Æº» «—ıªØº¡”÷ «ªπ‘≠º¡ |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫µ•—°Ã‚
A£ÆCuO Cu Cu | B£ÆFe2+ Fe Fe | C£ÆH2SO4 SO2 SO2 | D£ÆHCl Cl2 Cl2 |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫µ•—°Ã‚
A£Æ µ—È “÷∆““œ©£∫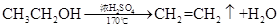 |
B£Æ±Ω∑”ƒ∆»Ð“∫Õ®»Î…Ÿ¡øCO2£∫ |
C£Æ““À·±Ω∑”ı•‘⁄◊„¡øµƒNaOH»Ð“∫÷–ÀÆΩ‚£∫ |
D£Æ𧓵÷∆怓“œ©£∫ |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫µ•—°Ã‚
| A£ÆC | B£ÆC∫ÕS | C£ÆKNO3 | D£ÆS∫ÕKNO3 |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫µ•—°Ã‚
A£Æ ≥—Œ÷–“ı¿Î◊”µƒΩ·ππ æ“‚ÕºŒ™£∫ |
| B£Æ’·Ã«∫Õ¥◊À·∂º «»ıµÁΩ‚÷ |
C£Æ°∞84œ˚∂æ“∫°±÷–”––ß≥…∑÷NaClOµƒµÁ◊” ΩŒ™£∫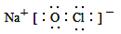 |
| D£Æ√˜∑ػГ∫ÀÆΩ‚ø…÷∆µ√Al(OH)3Ω∫㨔√”⁄…±æ˙œ˚∂æ |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫≤ªœÍ –գ∫µ•—°Ã‚
| A£ÆCl2°˙Cl- | B£ÆZn2+°˙Zn | C£ÆH2°˙H2O | D£ÆCuO°˙CuCl2 |
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com