
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
有关下列装置的叙述不正确的是
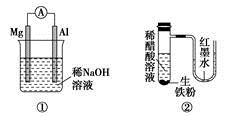
A.图①铝片发生的电极反应式是:Al+4OH--3e-===AlO2-+2H2O
B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+===Fe2++H2↑
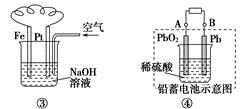
C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.图④充电时,阳极反应是:PbSO4+2H2O-2e-===PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
某同学通过系列实验探究硫及其化合物的性质,实验现象正确且能达到目的的是
A.点燃硫磺.产生刺激性气味气体,该气体可以漂白纸浆
B.向蔗糖中加入浓硫酸,蔗糖变黑色,说明浓硫酸具有强的吸水性
C.将H2S气体通入CuSO4溶液生成CuS沉淀,说明H2S为强电解质
D.将Al片加入浓硫酸中,反应剧烈,说明浓硫酸具有强的氧化性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列化学用语正确的是
A.Mg2+的电子式: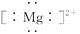
B. 甲烷的比例模型:
C.已知Ni与Co的化合价均只有+2和+3,则在Ni0.25Co0.75(OH)2中Ni的化合价是+2
D.聚氯乙烯的结构简式: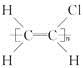
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列说法不正确的是
A.2013年0点钟声敲响后的几个小时,北京的污染指数从轻度污染上升为重度污染,主要污染为PM2.5污染,看来烟花爆竹的燃放,可加重PM2.5污染
B.催化剂之所以能加快反应速率,是因为催化剂能降低反应的活化能
C.氨气的水溶液氨水可以导电,因此氨气是电解质
D.大量燃烧含硫燃料是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合4 题型:简答题
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺,将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是 。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵 D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有 。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II. FeCl3溶液浸取工艺其生产流程如下图所示
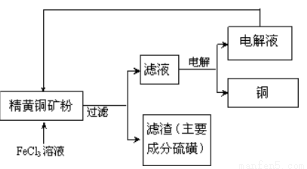
(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是 (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时,溶液中Pb2+物质的量浓度为 mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合2 题型:简答题
CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
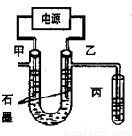
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为___。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH)2的Ksp=2.2×10-20)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.向煤中加入生石灰可减少对大气的污染
C.完全由非金属元素组成的化合物可以形成离子化合物
D.由氮气为原料合成氨是氮的固定
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:填空题
历史上金、银、铜主要是作为货币金属或装饰品被应用。
(1)金、银、铜常被作为钱币流通,从化学角度来看,主要是利用它们的 。
A.硬度适中
B.密度适中
C.在自然界里都可得到纯净的单质
D.不活泼性
(2)一位收藏者有一枚表面是黑色,且有少量绿色锈状物的货币,这肯定是 币,黑色物质是 ,形成这种物质的化学方程式为 ,绿色物质是 ,形成这种物质的化学方程式为 ,这枚金属币的真面目为 色。另外一枚是闪闪发光的黄色金属币,它肯定是 币,表面一直未被氧化的原因是 。
(3)不法分子有时用铜锌合金制成假金币行骗。下列方法中能有效鉴别其真假的是 。
A.观察颜色
B.查看图案
C.用手掂量轻重
D.滴一滴硝酸在币的表面,观察现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com