
| A、98克H2SO4和H3PO4 含有的氧原子数均为4NA. |
| B、1L1mol?L-1 的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA |
| C、33.6LNO2 溶解于足量的水中得到的硝酸溶液,溶液中NO3-数目为NA |
| D、32克铜发生氧化还原反应,一定失去NA 个电子 |
| 32g |
| 64g/mol |


科目:高中化学 来源: 题型:
| n(Na2CO3) |
| n(NaHCO3) |
| A、若a=1,则:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、若a=2,则:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、a为任意值时:c(Na+)+c(H+)=c(HCO32-)+2c(CO32-)+c(OH-) |
| D、若满足:3c(H+)+2c(HCO3-)+5c(H2CO3)=3c(OH-)+c(CO32-),则可确定a=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
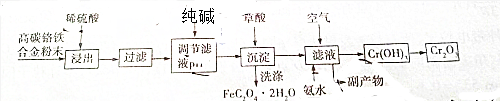
查看答案和解析>>
科目:高中化学 来源: 题型:
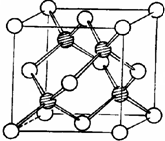 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.48 L |
| B、5.6 L |
| C、6.72 L |
| D、7.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
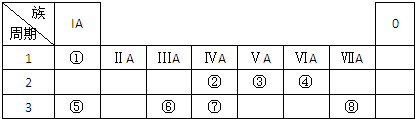
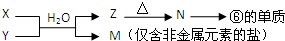 X溶液与Y溶液反应的离子方程式为
X溶液与Y溶液反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HA是弱酸 |
| B、若升高温度,溶液的PH增大 |
| C、此酸的电离平衡常数约为10-5 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的108倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com