
| A、73% | B、36% |
| C、24% | D、12% |
| 2x |
| 2-2x+1-x+2x+x |
| 0.36mol |
| 1mol |


科目:高中化学 来源: 题型:
| A、NH4CuSO3中硫元素被氧化了 |
| B、刺激性气味的气体是二氧化硫或氨气 |
| C、该反应中NH4CuSO3既是氧化剂又是还原剂 |
| D、该反应中硫酸既表现为酸性又表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
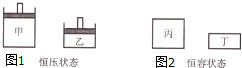 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是| V |
| 2 |
| A、图1达平衡时,浓度c(SO2):甲=乙 |
| B、图1达平衡时,平衡常数K:甲>乙 |
| C、图2达平衡时,所需时间t:丙<丁 |
| D、图2达平衡时,体积分数φ(SO3):丙>丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
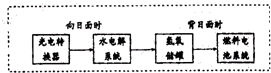 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.查看答案和解析>>
科目:高中化学 来源: 题型:
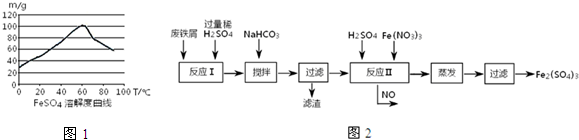
| n(Fe) |
| n(H2SO4) |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com