
【题目】海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程。
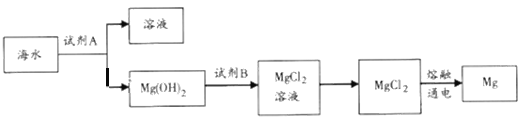
①工业上常用于沉淀Mg2+的试剂A是__________(填化学式),Mg(OH)2转化为MgCl2的离子方程式为________________________。
②由无水MgCl2制取Mg的化学方程式是______________________。
(2)海带灰中富含以I-形式存在的碘元素,实验室提取I2的途径如下所示:
![]()
①灼烧海带至灰烬时所用的主要仪器是__________(填名称);
②向酸化的滤液中加过氧化氢溶液,该反应的离子方程式为__________;
③反应结束后,加入CCl4作萃取剂,采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
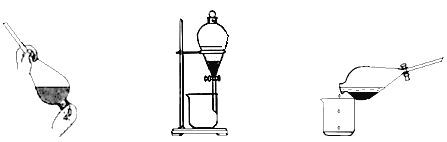
甲.加入萃取剂后振荡 乙.静置分层 丙.分离
甲、乙、丙3步实验操作中,错误的是__________(填“甲”、“乙”或“丙”)。
(3)海水中部分离子的含量如下:
成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
若从100L该海水中提取镁,理论上需加入试剂A__________g。
【答案】Ca(OH)2 Mg(OH)2+ 2H+= Mg2++H2O MgCl2(熔融) ![]() Mg+Cl2↑ 坩埚 2H++H2O2+2I-=I2+2H2O 丙 392.2g
Mg+Cl2↑ 坩埚 2H++H2O2+2I-=I2+2H2O 丙 392.2g
【解析】
(1)①工业上用可溶性碱与镁离子反应生成 Mg(OH)2,所以工业上常用于沉淀Mg2+的试剂A是Ca(OH)2,氢氧化镁是碱,能与酸反应生成镁盐和水,则Mg(OH)2转化为MgCl2的离子方程式是Mg(OH)2+ 2H+= Mg2++H2O;
②氯化镁是离子化合物,由无水MgCl2制取Mg的化学方程式是MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)①坩埚可以加强热,所以灼烧固体用坩埚;
②过氧化氢具有氧化性,碘离子具有还原性,在酸性溶液中发生氧化还原反应生成碘单质和水,该反应的离子方程式为2H++H2O2+2I-=I2+2H2O;
③ 在萃取、分液操作中,分液时,先把下层液体从分液漏斗的下口流出,然后上层液体从分液漏斗上口倒出,所以甲、乙、丙3步实验操作中,不正确的是丙;
(3)根据表中数据可知Mg2+的物质的量浓度是![]() ;100L的海水中Mg2+的含量=0.053mol/L
;100L的海水中Mg2+的含量=0.053mol/L![]() 100L=5.3mol,加入A即氢氧化钙发生沉淀反应,1mol Mg2+需要1mol氢氧化钙完全沉淀,因此若从100L的海水中提取镁,理论上加入沉淀剂氢氧化钙的质量=5.3mol
100L=5.3mol,加入A即氢氧化钙发生沉淀反应,1mol Mg2+需要1mol氢氧化钙完全沉淀,因此若从100L的海水中提取镁,理论上加入沉淀剂氢氧化钙的质量=5.3mol![]() 74g/mol=392.2g。
74g/mol=392.2g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3=NH4Cl
B.2Na2O2+2H2O=4NaOH+O2↑
C.2N2O5(g)=4NO2(g)+O2(g)
D.Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰) Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇之间转化的能量关系如图所示。
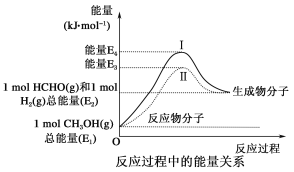
(1)甲醇催化脱氢转化为甲醛的反应是_______(填“吸热”或“放热”)反应;
(1)过程Ⅰ与过程Ⅱ的反应热______(填“相同”或“不同”),原因是___________________________________________________________;
(2)写出甲醇催化脱氢转化为甲醛的热化学方程式
__________________________________________________________;
(3) 甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700℃,需向体系中通入空气,通过计算确定进料甲醇与空气的物质的量理论比值为___________________________。(假设:H2(g)+1/2O2(g)===H2O(g) ΔH=-a kJ·mol-1,空气中氧气含量为20%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O==O | P==O |
键能kJ/mol | 197 | 360 | 499 | x |
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。
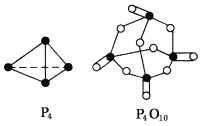
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g) ===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B. 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g) ===2CO(g) ΔH=-110.5 kJ·mol-1
C. 已知:H2(g)+ ![]() O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D. 已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在体积不变的5L密闭容器中,充入2molCO、3molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g),平衡后CH3OH的物质的量为1mol。下列叙述正确的是
CH3OH(g),平衡后CH3OH的物质的量为1mol。下列叙述正确的是
A. 随反应的进行,气体的平均相对分子质量逐渐减小
B. H2的平衡转化率为50%
C. 该温度反应的平衡常数K=25L2·mol-2
D. 平衡后再往容器中通入3mol CO,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: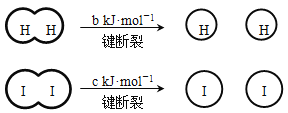 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳一样也存在一系列氢化物如NH3、N2H4、N3H5、N4H6等。
(1)N3H5的电子式为_______。
(2)已知4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=a kJ/mol K1①;
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=b kJ/mol K2②;
写出N2与O2反应生成1 mol NO气体的热化学方式程式为________________________;
(3)已知NH3·H2O为一元弱碱,N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O+H2O![]() N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
N2H5·H2O++OH-,则可溶性盐盐酸肼(N2H6Cl2)溶液中离子浓度由大到小的顺序为___________________________________。
(4)如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)

①向M、N中,各通入2 mol N2和6 mol H2。初始M、N容积相同,并保持温度不变。则到达平衡时H2的转化率α(H2)为M________N(填“>”“=”“<”)。
②若在某条件下,反应N2(g)+3H2(g)![]() 2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
2NH3(g)在容器N中达到平衡,测得容器中含有1.0 mol N2、0.4 mol H2、0.2 mol NH3,此时容积为2.0 L。则此条件下的平衡常数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com