
| A. | 3:1 | B. | 5:1 | C. | 4:1 | D. | 9:2 |
分析 Fe和稀硝酸反应方程式为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,根据方程式计算被还原的硝酸的物质的量分析解答.
解答 解:若铁和硝酸反应生成硝酸铁,
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
56 252
m n
n:m=9:2
若铁和硝酸反应生成硝酸亚铁,
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
168 504
m n
n:m=3:1
若铁和硝酸反应酸性硝酸亚铁和硝酸铁,
则:3:1<n:m<9:2,
则只有B不符合,
故选B.
点评 本题考查了氧化还原反应定量计算,为高频考点,侧重于学生的分析、计算能力的考查,掌握硝酸和铁反应的特征理解应用,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是LiOH | |
| B. | 离子的氧化能力最强的是Cs+ | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 单质的熔点随相对原子质量的增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| B. | 10 g46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| C. | 200 ml1mol/LFe2(SO4 )3溶液中,Fe3+和SO42-离子数的总和是NA | |
| D. | 可用电解氯化镁溶液的方法制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 和SO2气体同时通入BaCl2溶液中 | |
| B. | SO2气体通入BaCl2溶液中 | |
| C. | SO2气体通入Ba(NO3)2溶液中 | |
| D. | SO2气体和过量NH3 同时通入BaCl2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
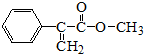 所示.
所示. 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
 .
. .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$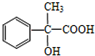 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烯、聚乙烯、苯乙炔都是不饱和烃 | |
| B. | 苯能与溴水在一定条件下发生取代反应 | |
| C. | 减少化石燃料使用,有利于降低空气中PM2.5(直径2.5μm以下细颗粒物)的含量 | |
| D. | 乙烯、苯、甲苯都能使高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com