
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,S2O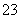 与Cl2反应的产物之一为SO
与Cl2反应的产物之一为SO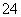 。下列说法中,错误的是( )
。下列说法中,错误的是( )
A.该反应中的氧化剂是S2O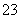
B.SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂
C.上述反应中,每生成1 mol SO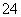 ,
, 可脱去2 mol Cl2
可脱去2 mol Cl2
D.根据该反应可判断还原性:S2O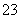 >Cl-
>Cl-
科目:高中化学 来源: 题型:
下列说法正确的是( )
①“方法”和“程序”是两个不同的概念,只有两者相互配合才能有效地完成研究物质性质的任务 ②“假说”是以已有事实材料和科学理论为依据,面对未知事实或规律所提出的一种推测性说明 ③“模型”是以客观事实为依据建立起来的,是对事物及其变化的简化模拟 ④研究物质性质的基本程序一般是:观察物质的外观→预测物质的性质→实验和观察→解释和结论
A.只有①②③ B.只有②③④
C.只有①③④ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+Cr2O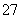 +H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
+H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
A.10 B.12
C.14 D.16
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3氧化酸性溶液中的KI:5I-+IO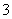 +6H+===3I2+3H2O
+6H+===3I2+3H2O
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH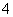 +OH-
+OH-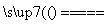 NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO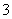 +NH
+NH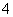
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO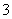 ===Ag++NO↑+H2O
===Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4 + 6Na2O2===2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
________________________________________________________________________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO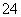 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO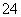 转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为短周期元素,X原子各电子层的电子数比为1∶4∶1,它比Y原子多3个电子。下列叙述错误的是( )
A.X离子半径小于Y离子半径
B.X单质在空气中燃烧不止生成一种化合物
C.Y的氢化物的稳定性比同族元素的高
D.X、Y形成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是( )
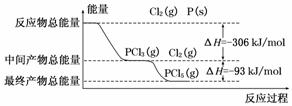
A.其他条件不变,降低温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热 ΔH=-798 kJ/mol
C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)===2PCl3(g) ΔH=-306 kJ/mol
D.其他条件不变,对于2PCl5(g)===2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
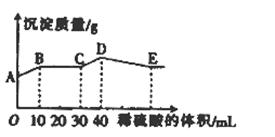
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
A.AB段发生反应的的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.BC段发生反应的离子方程式为:H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点表示的溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com