
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)根据表中数据可知,3s时NO为0.007mol,且不再随着时间的推移而减小,所以反应不能完全进行,据此判断反应是否是可逆反应,NO转化率=$\frac{反应的NO物质的量}{NO起始物质的量}$×100%;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO);根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
解答 解:(1)根据表中数据可知,3s时NO为0.007mol,且不再随着时间的推移而减小,所以反应不能完全进行,所以该反应是可逆反应,在第5s时,NO的浓度为$\frac{0.007mol}{2L}$=3.5×10-3mol•L-1,NO转化率=$\frac{(0.02-0.007)mol}{0.02mol}$×100%=65%,
故答案为:是;65%;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO)=$\frac{0.02mol-0.007mol}{2L}$=0.0065mol/L,所以图中表示NO2变化的曲线是b,2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{0.02mol-0.008mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)$\frac{1}{2}$=×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3mol•L-1•s-1.
点评 本题考查化学平衡计算、反应速率计算及读图表能力,难度不大,侧重考查学生分析解决问题能力.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
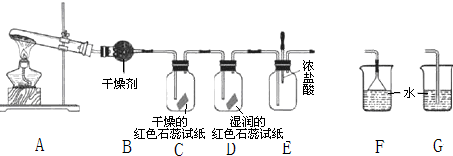

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
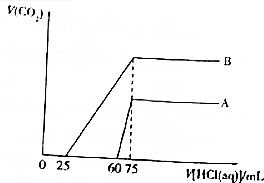 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下在水中溶解性比KHCO3>K2CO3 | |
| B. | 热稳定性K2CO3<KHCO3 | |
| C. | 和酸反应放出CO2的快慢KHCO3>K2CO3 | |
| D. | 等量的盐酸分别与足量KHCO3和K2CO3反应,产生CO2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生的反应都是置换反应 | B. | 实验所得滤液是纯水,可直接排放 | ||
| C. | 滤渣中一定含铜和锌 | D. | 反应前后液体的酸性减弱,pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=55.65kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.65kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.4kJ/mol | |
| D. | CH4(g)+2O2═CO2+2H2O△H=890.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水要现用现制,并保存在盖有橡胶塞的棕色瓶子中,置于冷暗处 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此一定不能与酸溶液发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com