
【题目】如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是_______;
(2)F的原子结构示意图是________;
(3)地壳中含量最多的元素是_______;
(4)Ne原子的最外层电子数是_______;
(5)N与O原子半径较大的是_______;
(6)H2S与HCl热稳定性较弱的是______;
(7)Na2O与MgO难与水反应的是______;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______;
(9)用于制造光导纤维的物质是______(填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____。
【答案】Na(或钠) ![]() O(或氧) 8 N(或氮) H2S(或硫化氢) MgO(或氧化镁) Al(OH)3(或氢氧化铝) SiO2 +1 2HClO
O(或氧) 8 N(或氮) H2S(或硫化氢) MgO(或氧化镁) Al(OH)3(或氢氧化铝) SiO2 +1 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)同周期元素从左到右金属性依次减弱,结合表中元素,金属性最强的元素是Na(或钠);
答案为:Na(或钠);
(2)F为9号元素,质子数=核外电子数,的原子结构示意图是![]() ;
;
答案为:![]() ;
;
(3)地壳中含量最多的前四种元素分别为氧、硅、铝、铁,含量最多的元素是O(或氧);
答案为:O(或氧);
(4)Ne为10号元素,位于第二周期零族元素,原子的最外层电子数是8;
答案为:8;
(5)N与O原子为同周期元素,从右至左,原子半径依次减小,半径较大的是N(或氮);
答案为N(或氮);
(6)非金属性越强,其气态氢化物越稳定,H2S与HCl热稳定性较弱的是H2S(或硫化氢);
答案为:H2S(或硫化氢);
(7)Na2O与水反应生成氢氧化钠;MgO难溶于水,不与水反应,难与水反应的是MgO(或氧化镁);
答案为:MgO(或氧化镁);
(8)Mg(OH)2是碱,不与碱反应;Al(OH)3是两性氢氧化物,既能与酸反应,又能与强碱反应;
答案为:Al(OH)3(或氢氧化铝)
(9)制造光导纤维的主要原料是二氧化硅;
答案为:SiO2
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为+1,HClO不稳定,易分解生成HCl和O2,其在光照条件下分解生成HCl和O2,化学方程式:2HClO![]() 2HCl+O2↑。
2HCl+O2↑。
答案为:+1;2HClO![]() 2HCl+O2↑;
2HCl+O2↑;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________。该反应中氧化产物是_____________(填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____(填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从溴乙烷制取1,2-二溴乙烷,下列制备方案中最好的是( )
A. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
C. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br
D. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)22.0g K2R中含有0.4mol钾离子,则该物质的摩尔质量为________,R的相对原子质量为________。
(2)在恒温条件下的密闭容器中,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当在左边充入1 mol N2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置。

①隔板左右两边气体的气体的分子数之比为______。
②右边混合气体中CO和CO2物质的量分别为________、________,该混合气体平均相对分子质量为______。
(3)现有20°C的饱和硫酸铜溶液,其质量分数为16%、密度为1.25g/cm3。则:
①20°C时,硫酸铜的溶解度为________;
②该饱和硫酸铜溶液的物质的量浓度为____;
③实验室需要250mL 0.5mol/LCuSO4溶液。在配制该溶液时需要称取胆矾(CuSO4·5H2O)的质量为____;
④取20mL 0.5mol/LCuSO4溶液恰好与50mLNaOH溶液反应,使Cu2+完全转化为沉淀。请计算氢氧化钠溶液的物质的量浓度(写出过程) ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为乙酸丁酯制备的实验装置,下列说法正确的是
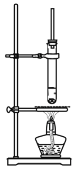
A.玻璃导管的主要作用是平衡试管内外压强
B.该装置适用于乙酸乙酯的制备
C.加入过量乙酸可以提高丁醇的转化率
D.分离提纯乙酸丁酯的方法是将混合物直接分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向某浓度的氯水中逐滴滴入Na2SO3溶液,无气体逸出,溶液pH变化如图所示,下列关系正确的是
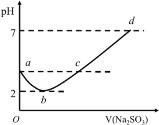
A.a点:c(H+)>c(Cl-)>c(ClO-)
B.b点:c(Cl-)=c(SO42-)=0.005mol·L-1
C.c点:c(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)
D.d点:c(Na+)=c(Cl-)+2c(SO32-)+2c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质:①氢氧化钠溶液、②铝片、③液态HCl 、④葡萄糖、⑤熔融的NaCl、⑥SO2 气体、⑦碳酸氢钠、 ⑧氧化铝
(1)属于电解质的是______________________。(填编号)
(2)能导电的是____________________________________。(填编号)
(3)①和②反应的离子方程式________________________________。
II.实验室可通过K2Cr2O7溶液测定补铁剂中FeSO4的含量,反应如下K2Cr2O7 +□FeSO4 +□H2SO4 =□Cr2(SO4)3+□Fe2(SO4)3+□K2SO4+□H2O
(1)配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目。_______________
(2)该反应的还原产物为__________。若反应中消耗1 mol K2Cr2O7,则转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
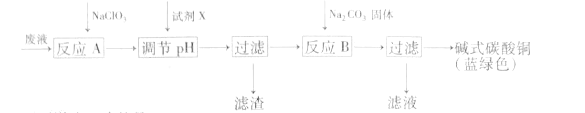
下列说法正确的是( )
A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O
B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜
C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化
D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
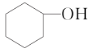
![]()
![]() +H2O
+H2O
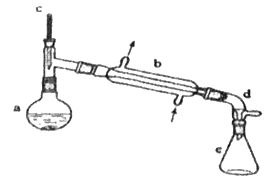
可能用到的有关数据如下:
相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________________。
(2)加入碎瓷片的作用是_____________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___________(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的__________(填“上口倒出”或“下口倒出”)。
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有_______(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com