
| A. | 质量 | B. | 体积 | C. | 物质的量 | D. | 氢原子数 |
分析 NH3和CH4的电子数为10,则含有电子数均为3.01×1024的NH3和CH4的物质的量相等,结合n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$以及分子构成计算.
解答 解:NH3和CH4的电子数为10,则含有电子数均为3.01×1024的NH3和CH4的物质的量相等,
A.因M(NH3)≠M(CH4),则等物质的量时二者质量不同,故A错误;
B.由于气体存在的条件未知,则不能确定体积大小,故B错误;
C.含有电子数均为3.01×1024的NH3和CH4的物质的量都为5mol,故C正确;
D.等物质的量时,含有的氢原子数之比为3:4,故D错误.
故选C.
点评 本题考查物质的量的计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意相关计算公式的运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 单质的熔沸点随原子序数增加而降低 | |
| D. | 单质的还原性随原子电子层数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol•L-1]:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入石蕊试液中证明SO2有漂白性 | |
| B. | 用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱 | |
| C. | 向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42- | |
| D. | 用干燥的pH试纸可测得新制氯水的pH=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
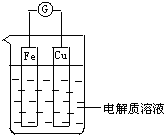 如图所示,组成一个原电池.
如图所示,组成一个原电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com