
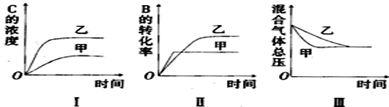
| A. | 图I研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的可能是压强对反应的影响,且甲的压强较高 | |
| C. | 图Ⅱ研究的可能是温度对反应的影响,且甲的温度较高 | |
| D. | 图Ⅲ研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
分析 A.催化剂可加快反应速率,但平衡不移动;
B.该反应为气体体积减小的反应,增大压强,平衡正向移动;
C.该反应为放热反应,升高温度,反应速率加快,平衡逆向移动;
D.图Ⅲ中达到平衡时总压强不变,甲的反应速率快.
解答 解:A.催化剂可加快反应速率,但平衡不移动,图中C的浓度不变,则不可能为催化剂对反应的影响,故A错误;
B.该反应为气体体积减小的反应,增大压强,平衡正向移动,则B的转化率增大,与图象不符,故B错误;
C.该反应为放热反应,升高温度,反应速率加快,平衡逆向移动,则B的转化率减小,与图象符合,故C正确;
D.图Ⅲ中达到平衡时总压强不变,甲的反应速率快,则图Ⅲ研究的可能是不同催化剂对反应的影响,且甲使用的催化剂效率较高,故D错误;
故选C.
点评 本题考查化学平衡的移动,为高频考点,把握温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意图象的分析与平衡移动的结合,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
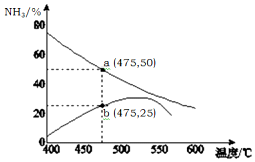 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+
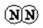 $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥ | B. | ①②③④ | C. | ①②④⑥ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com