
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,
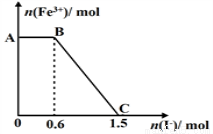
下列说法中不正确的是
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7可与FeSO4反应的物质的量为1:3。
D
【解析】
试题分析:A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故A正确;B.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故B正确;C.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为1.5mol÷6=0.25mol,故C正确;D.由方程式2Fe3++2I-=2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误,故选D。
考点:考查氧化还原反应的应用与计算


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述中正确的是
(1)纯铁比碳素钢易生锈
(2)用氨水除去试管上的银镜
(3)硅是制作光导纤维和制造太阳能电池的主要原料
(4)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性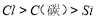
(5)催化剂只能改变反应的活化能,不能改变反应的热效应
(6)用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
(7)同主族元素的简单阴离子还原性越强,水解程度越大
(8)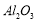 在工业上用于制作耐高温材料,也用于电解法治炼铝
在工业上用于制作耐高温材料,也用于电解法治炼铝
(9)丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
(10)明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视
A.(1)(4)(6)(7) B.(4)(6)(9)(10)
C.(3)(5)(6)(8) D.(5)(6)(8)(9)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:实验题
(6分)某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
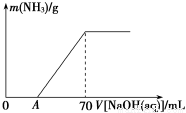
(1)A点前样品与NaOH反应的离子方程式为__________________________________
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的________。
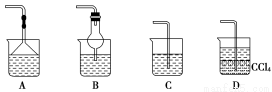
(3)样品中(NH4)2CO3的质量分数是________%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是:
A、标准状况下,33.6 L SO3中含有的氧原子数是4.5NA
B、1 mol OH-和1 mol—OH(羟基)中含有的电子数均为9NA
C、在加热条件下,100 mL18.4 mol/L的浓硫酸与足量金属铜反应得到的SO2的分子数为0.92 NA
D、当0.2 mol Na218O2与足量CO2完全反应后,生成碳酸钠的质量为21.6 g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:填空题
(10分)高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,___ _ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
①干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
②湿式氧化法的流程如下图:
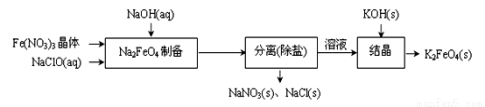
上述流程中制备Na2FeO4的化学方程式是: 。
(4)高铁电池是正在研制中的可充电电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。
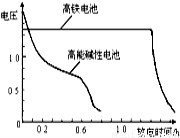
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO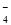 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中不正确的有
A.标准状况下,20 g重水(D2O)中含有的电子数为10NA
B.乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
C.22.4 L的N2的共用电子对数为3NA
D.78gNa2O2固体中含有的阴离子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.Fe和稀硫酸反应:2Fe+6H+== 2Fe3++3H2↑
B.Na2O2溶于水产生O2:Na2O2+H2O == 2Na++2OH–+O2↑
C.用石墨做电极电解饱和MgCl2溶液:2Cl–+2H2O Cl2↑+H2↑+2OH–
Cl2↑+H2↑+2OH–
D.强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:4OH–+3ClO–+2Fe (OH)3 == 2FeO42–+3Cl–+5H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com