



 ,故答案为:
,故答案为: ;
;| 1 |
| 2 |
| 1 |
| 2 |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011年四川省绵阳中学高考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
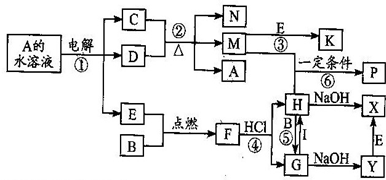
已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,反应②为D的浓溶液与C在加热条件下的反应。P溶液和G溶液中具有相同的阳离子。请根据要求回答下列问题:

(1)写出I的化学式 。
(2)写出反应①中阴极发生的电极反应式
,
写出反应①的化学方程式
。
(3)写出反应④的离子方程式
,
写出反应⑤的离子方程式
,
写出反应⑥的离子方程式
。
(4)每生成1mol气态K,反应放出98.3kJ热量,该反应的热化学方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com