
���� �����Ȼ�ѧ����ʽ��д����������Ȼ�ѧ���̵����塢��ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ�д����
��4����CH3COOH��l��+2O2��g���T2CO2��g��+2H2O��l����H1=-870.3kJ/mol
��C��s��+O2��g���TCO2��g����H2=-393.5kJ/mol
��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H3=-258.8kJ/mol
��ϸ�˹���ɿ�֪���ڡ���+�ۡ�2-�ٵõ�2C��s��+2H2��g��+O2��g���TCH3COOH��l�����Դ������
��� �⣺��1��1mol C2H5OH��l����ȫȼ������CO2��g����H2O��l�����ų�1366.8KJ��������ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ�ʱ�д���Ȼ�ѧ����ʽΪ C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1366.8KJ/mol���ʴ�Ϊ��C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1366.8KJ/mol��
��2��1mol̼��ʯī��������ˮ������ȫ��Ӧ������һ����̼���������������131.3KJ�������Ȼ�ѧ����ʽΪ��C��s��+H2O ��g��=CO��g��+H2 ��g����H=+131.3kJ/mol��
�ʴ�Ϊ��C��s��ʯī��+H2O ��g��=CO��g��+H2 ��g����H=+131.3kJ/mol��
��3��1.7g ��0.1molNH3��g��������������Ӧ������̬����ų�22.67kJ������������4molNH3��g��������������Ӧ������̬����ų�22.67kJ��40=906.80kJ����������4NH3��g��+5O2��g���T4NO��g��+6H2O��g����H=-906.80kJ/mol��
�ʴ�Ϊ��4NH3��g��+5O2��g���T4NO��g��+6H2O��g����H=-906.80kJ/mol��
��4����CH3COOH��l��+2O2��g���T2CO2��g��+2H2O��l����H1=-870.3kJ/mol
��C��s��+O2��g���TCO2��g����H2=-393.5kJ/mol
��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H3=-258.8kJ/mol
��ϸ�˹���ɿ�֪���ڡ���+�ۡ�2-�ٵõ�2C��s��+2H2��g��+O2��g���TCH3COOH��l������H=��-393.5kJ/mol-258.8kJ/mol����2-��-870.3kJ/mol��=-488.3kJ/mol��
�ʴ�Ϊ��-488.3kJ/mol��
���� ���⿼�����Ȼ�ѧ����ʽ�ķ����жϣ��Ȼ�ѧ����ʽ�ļ���Ӧ�ã�ע����д���������ջ����ǹؼ�����Ŀ�ϼ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������������к�θ�ᡢ�⾷ֹʹ�����ã�θʹ��θ�����Ļ��߿ɴ������� | |
| B�� | ʳ�ο�����ζ����Ҳ����ʳƷ������ | |
| C�� | ��Ȼ���ڵĶ�ֲ����֬�������ǻ���û�й̶����۷е� | |
| D�� | �����ǿ�����Ⱦ��г�������ζ���о綾 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 $\stackrel{һ������}{��}$
$\stackrel{һ������}{��}$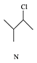 $\stackrel{һ������}{��}$
$\stackrel{һ������}{��}$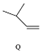 ������˵����ȷ���ǣ�������
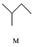
������˵����ȷ���ǣ�������| A�� | M������Ϊ�춡�� | |
| B�� | N��ͬ���칹����7�֣������������칹�������������� | |
| C�� | Q������ˮ��Ӧ����N | |
| D�� | M��N��Q����ʹ����KMnO4��Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2��g��+3H2��g��?2NH3��g��[�ڻ�������Цգ�NH3��=33.3%] | |
| B�� | CO��g��+H2O��g��?CO2��g��+H2��g�����ں��������У�������ѹǿ���ٸı䣩 | |
| C�� | 2SO2��g��+O2��g��?2SO3��g�����ں�ѹ�����£����������ٸı䣩 | |
| D�� | 2NO2��g��?2NO��g��+O2��g�����ں��������£�������ɫ���ٸı䣩 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �٢ܢݢ� | C�� | �ڢۢܢ� | D�� | �ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| װ������ | ʵ��ǰ/g | ʵ���/g |
| B | 22.6 | 42.4 |
| E����������ܣ� | 80.2 | 146.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol/L | B�� | 0.2 mol/L | C�� | 0.3 mo/L | D�� | 0.4 mo/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com