
 如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.
如图为Mg-NaClO燃料电池结构示意图.已知电解质溶液为NaOH溶液,且两电极中有一电极为石墨电极.| Kw |
| c(OH-) |


科目:高中化学 来源: 题型:
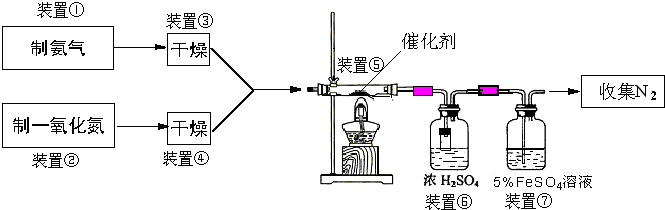
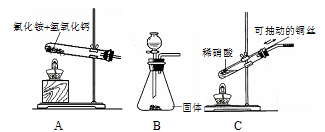
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石墨比金刚石稳定 |
| B、金刚石比石墨稳定 |
| C、相同物质的量的石墨比金刚石的总能量高 |
| D、两者互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 可能的实验现象 | 解释 | |||
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO
| ||
| B | 向CaSO3中加入硝酸 | 有刺激性气味的气体生成 | CaSO3与硝酸反应生成SO2 | ||
| C | 同温同压下用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠溶液发生了水解 | ||
| D | 向淀粉KI溶液中通入Cl2 | 溶液变蓝 | Cl2与淀粉发生显色反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥ | B、②④ |
| C、②③④ | D、②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 实验步骤(不要写出具体操作过程) | 预期实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2 |
| B、NaOH |
| C、AgNO3 |
| D、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1mol氦气含有的原子数为NA |
| B、0.10 mol?L-1 NaCl溶液中含有Cl-离子数是0.1 NA |
| C、NA个O2分子的质量是16 g |
| D、标准状况下,22.4 L水中含有的水分子数是NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com