
分析 (1)准确配制一定体积一定物质的量浓的溶液的步骤选择用到的仪器,主要步骤有计算、称量、溶解、转移、洗涤并转移、定容、摇匀;
(2)残缺方程式配平首先确定缺什么,根据电子转移守恒、原子守恒,配平化学方程式;
(3)酸式滴定管可以量取具有强氧化性的溶液,高锰酸钾具有颜色,锰离子无色;
(4)根据化学方程式计算消耗过氧化氢的量然后计算质量分数;
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则消耗的标准溶液的体积偏大.
解答 解:(1)准确配制一定体积一定物质的量浓的溶液用容量瓶,
故答案为:容量瓶;
(2)方程式中,高锰酸钾有强氧化性,能将双氧水氧化为氧气,先确定缺的是O2,锰元素化合价降低了5价,生成1mol氧气时,氧元素化合价升高2价,根据电子转移守恒,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据原子守恒来配平其他物质前面的系数,离子方程式2MnO4-+5H2O2+6H+=2Mn2++8H2O+502↑,
故答案为:2、5、6、2、8、5O2;
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管,滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色,
故答案为:酸式;滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;
(4)根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用c mol/L KMnO4标准溶液V mL,即cV×10-3mol的高锰酸钾时,所用双氧水的物质的量:2.5cV×10-3mol,则原过氧化氢的质量为:0.025cVmol×34g/mol=0.85cV,过氧化氢溶液中过氧化氢的质量分数为:$\frac{0.85cV}{10.00ml×ρg/ml}$×100%=$\frac{0.085cV}{ρ}$×100%,
故答案为:$\frac{0.085cV}{ρ}$×100%;
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则消耗的标准溶液的体积偏大,所以计算的KMnO4的物质的量偏大,则过氧化氢的物质的量偏大,所以测得结果偏高,
故答案为:偏高.
点评 本题是一道综合知识题目,涉及仪器的选择、离子方程式的配平、滴定终点的确定、质量分数的计算,要求学生具有分析和解决问题的能力,注意把握中和滴定实验原理和操作方法,题目难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题

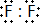 ,两者气态氢化物的稳定性是:HF>HCl(填写化学式).
,两者气态氢化物的稳定性是:HF>HCl(填写化学式).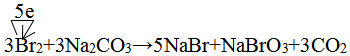 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
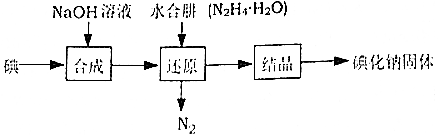
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛与乙酸乙酯的混合物中含氧原子数为NA | |
| B. | 40gH2${\;}_{\;}^{18}$O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 62gNa2O与78gNa2O2所含的阴离子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
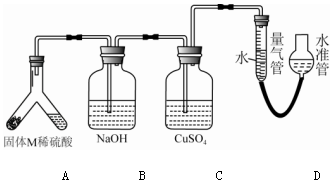
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl2$\stackrel{Cu}{→}$Fe | |
| C. | FeS2$\stackrel{O_{2}/高温}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | NH3$→_{催化剂}^{O_{2},△}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
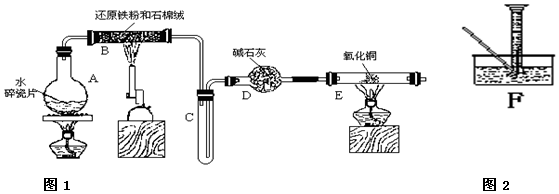
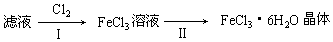
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 结论 |
| A | 配制Fe(NO3)2溶液时加入适量的硝酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 往溶液中滴加NaOH溶液,将湿润红色石蕊试纸置于试管口试纸不变蓝 | 原溶液中无NH4+ |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com