
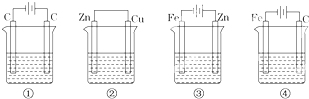
分析 (1)有外加直流电源的为电解池;与电源正极相连的电极为阳极发生氧化反应;
(2)装置①中是用惰性电极电解硫酸铜溶液,阳极上氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电,电极反应式为Cu2++2e-=Cu,所以通电时装置①中的总反应式是2Cu2++2H2O═O2↑+4H++2Cu;
(3)根据各个装置中氢离子或氢氧根离子浓度变化判断;
(4)若将装置④中的外加电源正负极对换,所以铁是阳极,阳极:2Fe-4e-=2Fe2+,阴极:2H++2e-=H2↑.
解答 解:(1)有外接电源的属于电解池,没有外接电源的属于原电池,所以属于电解池的是①③④,
故答案为:①③④;
(2)装置①中是用惰性电极电解硫酸铜溶液,阳极上氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电,电极反应式为Cu2++2e-=Cu,所以通电时装置①中的总反应式是2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+4H++2Cu,故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+4H++2Cu;
(3)①电解硫酸铜溶液时,阳极上水电离出来的氢氧根离子放电,阴极上铜离子放电,导致溶液中氢离子浓度增大,酸性增强,pH减小;
②中锌失电子发生氧化反应,氢离子得电子发生还原反应,导致溶液中氢离子浓度减小,溶液的PH增大,溶液始终显酸性;
③中阳极上锌失电子发生氧化反应,阴极上锌离子放电,导致溶液中氢离子浓度不变,pH不变;
④中阳极上氯离子放电,阴极上氢离子放电,导致溶液中氢离子浓度减小,溶液的PH增大,溶液显碱性,
所以则上述四种装置中溶液pH最小的是②,
故选②;
(4)若将装置④中的外加电源正负极对换,所以铁是阳极,阳极:2Fe-4e-=2Fe2+,阴极:2H++2e-=H2↑,故答案为:阴极:2H++2e-=H2↑;阳极:2Fe-4e-=2Fe2+.
点评 本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 向Na2SiO3溶液中逐滴加入稀盐酸:2H++SiO32-═H2SiO3(胶体) | |
| C. | 向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ | |
| D. | 将铜片投入浓硝酸中:2NO3-+3Cu+8H+═3Cu2++2NO2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2分别为0.4mol•L-1、0.2mol•L-1 | |
| B. | SO2为0.25mol•L-1 | |
| C. | SO2、SO3均为0.15mol•L-1 | |
| D. | SO3为0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
(1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D的结构式:H-O-H.
;D的结构式:H-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁做阳极材料电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 碱性甲烷燃料电池的负极反应式:CH3OH-6e-+6OH-═CO2+5H2O | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-→Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2 MgCl2 AlCl3 | B. | AgNO3KNO3 Na2CO3 | ||
| C. | NH4Cl (NH4)2SO4 K2SO4 | D. | Na2CO3 NaHCO3K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,上层液体从下口放出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
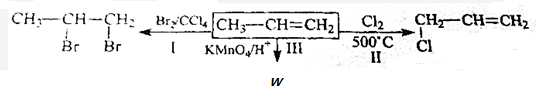 ,下列Ⅰ、Ⅱ、Ⅲ反应的类型正确的是( )
,下列Ⅰ、Ⅱ、Ⅲ反应的类型正确的是( )| A. | 加成、加成、氧化 | B. | 加成、氧化、氧化 | C. | 加成、取代、氧化 | D. | 取代、取代、加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com