
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O;ΔH=-483.6 kJ·mol-1
2H2O;ΔH=-483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的ΔH=________。
2NH3(g)的ΔH=________。
(2)工业上在一定温度下,将一定量的N2和H2通入到体积为
①增大压强②增大反应物的浓度③使用催化剂④降低温度
(3)当化学反应N2(g)+2H2(g) ![]() 2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将
2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将

(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:

①请写出氢氧燃料电池中的电极反应式:
负极:____________________________________________________________;
正极:____________________________________________________________。
②上图装置中,某一铜电极的质量减轻了
(1)-92.4 kJ·mol-1
(2)①②
(3)t0—t1 ![]() (mol·L-1) -2
(mol·L-1) -2
(4)①负极:2H2+4OH--4e-![]() 4H2O正极:O2+2H2O+4e-
4H2O正极:O2+2H2O+4e-![]() 4OH-
4OH-
②0.56
解析:(1)①-②×![]() +3×
+3×![]() 得
得
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
(2)催化剂不能改变平衡,平衡常数随温度变化而变化,因此只有①②符合。
(3)NH3含最高一段为t0-t1,K=![]() (mol·L-1)-2
(mol·L-1)-2
(4)①负极:2H2+4OH--4e-![]() 4H2O
4H2O
正极:O2+2H2O+4e-![]() 4OH-
4OH-![]()
②n(Cu)=![]() =0.05 mol
=0.05 mol
n(e-)=0.1 mol
n(O2)=0.025 mol V(O2)=


科目:高中化学 来源:2013届辽宁省沈阳市第二十中学高三高考领航考试(三)化学试卷(带解析) 题型:填空题
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
C(s)+O2(g) =CO2(g);△H=" -393.5" kJ/mol
2C(s)+O2(g)=2CO(g);△H= -221kJ/mol
则2NO(g)+2CO(g) N2(g) +2CO2(g)的△H=___________。
N2(g) +2CO2(g)的△H=___________。
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,且N2占平衡总体积的1/4。
①则该反应的平衡常数K=_______ ____。(用只含a、V的式子表示)
②判断该反应达到平衡的标志是____ _____
A.v生成(CO2)=v消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是___________
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
①写出此变化中的总化学反应方程式:________________________________________。
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。请你判断是否可行并说出理由:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2009—2010学年广州市七区联考高二化学下学期期末监测 题型:计算题
(8分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)="2NO(g) " △H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H= kJ/mol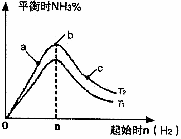
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T1和T2的关系是:T1_______T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是________(填字母).
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数。(写出计算过程,结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源:2013届安徽省怀宁中学高三上学期开学水平检测考试化学试卷(带解析) 题型:填空题
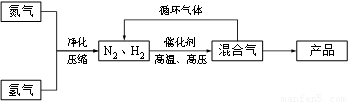
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
回答下列问题:
(1) 已知: N2(g) + O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH ?905kJ/mol
?905kJ/mol
2H2(g) + O2(g)  2H2O(g) ΔH
2H2O(g) ΔH ?483.6kJ/mol
?483.6kJ/mol
则N2(g) + 3H2(g) ≒ 2NH3(g) ΔH ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高三上学期开学水平检测考试化学试卷(解析版) 题型:填空题
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
回答下列问题:
(1) 已知: N2(g)
+ O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g)
+ 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH −905kJ/mol
−905kJ/mol
2H2(g)
+ O2(g)  2H2O(g) ΔH
2H2O(g) ΔH −483.6kJ/mol
−483.6kJ/mol
则N2(g)
+ 3H2(g) ≒ 2NH3(g) ΔH  ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com