
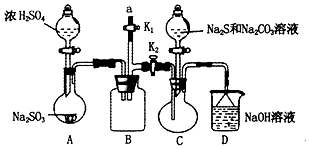
 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
| 2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
分析 A制备二氧化硫,B为安全瓶,还可以防止污染空气,C中制备Na2S2O3,D吸收尾气,
(1)有气体参与的实验需要检验装置气密性;
(2)反应开始时发生的反应为:Na2S+4SO2+H2O=2H2S+Na2SO3,SO2+2H2S=3S↓+2H2O,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解;
(3)根据亚硫酸钠易被氧化生成硫酸钠分析;
(4)K1处连接一个碱性溶液装置,实验完成,关闭K2,打开K1即可;
(5)①实验1、2中,其它条件相同,亚硫酸钠浓度浓度不同,故为探究亚硫酸钠浓度对亚硫酸钠转化率的影响;
②要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,其它条件相同情况下,应进行溶液pH不同、反应温度不同、硫粉质量不同对亚硫酸钠转化率影响对比实验;
③硫为固体,不影响平衡的移动.
解答 解:(1)实验开始前,检查装置气密性;
故答案为:检查装置气密性;
(2)反应开始时发生的反应为:Na2S+SO2+H2O=H2S+Na2SO3,SO2+2H2S=3S↓+2H2O,故该浑浊物是S,若SO2过量,溶液显酸性,产物分解,反应为:S2O32-+2H+=S↓+SO2↑+H2O;
故答案为:硫;S2O32-+2H+=S↓+SO2↑+H2O;
(3)因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
故答案为:先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3溶液;
(4)B装置可以起到安全瓶,防止倒吸的作用,另外在实验结束后拆除装置时还可以防止污染空气,K1处连接一个碱性溶液装置,实验完成,关闭K2,打开K1即可,方法为:在a处连接盛NaOH溶液的注射器,再关闭K2打开K1;
故答案为:在a处连接盛NaOH溶液的注射器,再关闭K2打开K1;
(5)①实验1、2中,其它条件相同,亚硫酸钠浓度浓度不同,故为探究亚硫酸钠浓度对亚硫酸钠转化率的影响;
故答案为:亚硫酸钠浓度;
②要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,其它条件应相同情况下,应进行溶液pH不同对比实验、反应温度不同对比实验、硫粉质量不同对比实验,除实验1、2外,至少还需进行3次对比实验;
故答案为:3;
③硫为固体,不影响平衡的移动,故不会影响亚硫酸钠转化率;
故答案为:硫为固体,不影响化学平衡的移动.
点评 本题考查学生对工艺流程的理解、实验装置的理解评价、实验操作与设计、物质性质、氧化还原反应滴定应用等,难度中等,需要学生具有扎实的基础与阅读题目获取信息、综合运用解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol氩气含有的原子数一定为NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液完全反应,转移电子总数为0.1NA | |
| C. | 56g铁片与足量浓硫酸共热反应生成NA个SO2分子 | |
| D. | 常温下,1L pH=12的Na2CO3溶液中含有CO32-的数目大于0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚油酸是一种植物油,常温下呈液态 | |
| B. | 1mol亚油酸可以与3molH2反应 | |
| C. | 亚油酸能使溴的四氯化碳溶液褪色 | |
| D. | 亚油酸可与NaOH溶液发生皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO、H2CO3、HNO3、HClO4的酸性依次增强 | |
| B. | NaCl中混有KNO3,可用蒸发结晶趁热过滤得到NaCl | |
| C. | HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键 | |
| D. | 以极性键结合的分子不一定是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 苯、溴水、铁粉混合制成溴苯 | |
| C. | 沸点:戊烷>丁烷>乙烷 | |
| D. | 由丙烯加溴制1,2-二溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有5个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g CO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5mol CH5+中含有的电子数目为5NA | |
| D. | 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
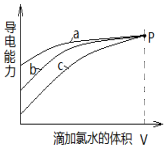
| A. | 曲线a代表H2SO3溶液 | |
| B. | 曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3-)+c(SO32-)+c(SO42-) | |
| C. | 曲线a、b、c代表的溶液中均始终保持:2c(Cl-)=c(SO42-) | |
| D. | 当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol-CH3中含有的质子数为10NA | |
| B. | 25℃时,1 L pH=ll的氨水中OH-的数目为0.001NA | |
| C. | 1 mol苯乙烯(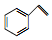 )中含有的碳碳双键数为4NA )中含有的碳碳双键数为4NA | |
| D. | 合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com