

| 3 |
| ||


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
| A、钡可从氯化钠溶液中置换出金属钠 |
| B、钡可从冷水中置换出氢气 |
| C、钡可从硫酸铜溶液中置换出铜 |
| D、在溶液中Ba2+可氧化金属锌,生成Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
| C、常温常压下,只有一种元素的单质是液态 | ||||
| D、常温常压下,气态单质的分子都是由非金属元素的原子形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3gNa与一定量氧气发生反应,钠无剩余,则转移电子数一定为0.1NA |
| B、常温常压下,100g17%H2O2水溶液中含氧原子总数为NA |
| C、常温常压下,2.24LN2气体分子中所含的共用电子对数目为0.3NA |
| D、5.6Fe分别足量氯气、盐酸反应,转移电子数都是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应能够制造新物质,同时也能制造出新的元素 |
| B、煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产物的过程叫煤的干馏 |
| C、在酿酒的过程中,葡萄糖可通过水解反应生成酒精 |
| D、工业生产玻璃、水泥、冶炼铁均需要用到石灰石为原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
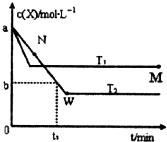 在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入一定量的X气体与Y气体并发生反应:2X(g)+Y(g)?2Z(g),测得在温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0?t1时间内,υ(Y)=
| ||
| C、M点的平衡常数比W点的平衡常数小 | ||
| D、M点时再加入一定量的X,平衡后X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ②乙烯 ③CH3COOH
②乙烯 ③CH3COOH
| A、①⑤ | B、①②④⑥ |
| C、①④ | D、①③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com