
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
分析 (1)探究温度和浓度对速率影响时,应考虑在同等条件下研究温度或浓度对速率的影响,即浓度相同时探究温度,温度相同时探究浓度;(2)
(2)探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度,实际就是证明反应后的混合液里既有I2生成,但Fe3+没有完全反应还有剩余;
①KI和FeCl3反应的离子方程式中I-发生氧化反应生成I2,且每生成1个I2,转移2e-,Fe3+被还原生成Fe2+,根据电子守恒、电荷守恒及原子守恒配平离子反应方程式;
②Fe3+的检验通常用KSCN溶液;
③因反应物中KI明显过量,则能说明反应有一定限度,就需要证明有I2生成,同时有Fe3+存在;
解答 解:(1)①和②温度不同,应该时探究温度对速率的影响,因此浓度要求相同,即溶液的总体积相同,则V1+5+5=5+5+40,得V1=40;②和③温度相同,应该时探究浓度对速率的影响,图表中KIO3酸性溶液体积相同,可知是改变亚硫酸钠的浓度,为达到溶液体积相同,5+V2+35=5+5+40,得V2=10,故答案为:40;10;
(2)①结合电子守恒,每生成1个I2转移2e-时,也生成2个Fe2+,再利用电荷守恒及原子守恒可得配平后的离子反应方程式:2I-+2Fe3+=I2+2Fe2+,故答案为:2;2;1;2;
②利用KSCN溶液检验反应后的溶液里存在Fe3+,故答案为:KSCN溶液;
③当ii中可观察到溶液分层,下层呈现紫红色是可知反应后的溶液里有I2,iii中滴加KSCN溶液后可观察到溶液变红,可知溶液里存在Fe3+,由此可推出反应存在一定限度,故答案为:ii中可观察到溶液分层,下层呈现紫红色,iii中可观察到溶液变红.
点评 探究型实验为高考高频考点,但基础性较强,理解反应实质是解题关键,难度不大,建议重视基本理论的理解与运用,夯实基础,提高分析问题解决问题的能力.


科目:高中化学 来源: 题型:解答题
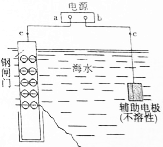 金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.
金属是日常生活和工农业生产中广泛使用的材料.恰当的金属防腐方法是延长金属材料使用寿命的前提.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
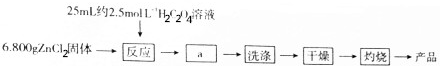
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题
回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变充入He气,体系压强增大,平衡逆向移动 | |
| B. | 保持压强不变充入He气,因为体系压强不变,所以平衡不移动 | |
| C. | 其它条件不变,向体系中加入A,A的转化率减小,B的转化率增大 | |
| D. | 其它条件不变,改变体积使压强改变,逆方向的速率改变的程度大于正方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
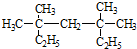 系统命名法为3,3,5,5-四甲基庚烷,
系统命名法为3,3,5,5-四甲基庚烷, ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com