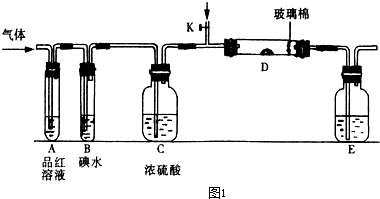
解答:解:Ⅰ、(1)①二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO
2和Cl
2,装置A中观察到的现象相同,都使品红褪色;二氧化硫和氧气在五氧化二钒作催化剂、加热条件下能发生氧化还原反应生成三氧化硫,反应方程式为 2SO
2+O
2 2SO
3,
故答案为:相同;2SO
2+O
2 2SO
3;
②SO
2通入B装置碘水中,溶液颜色退去,发生了氧化还原反应:碘单质具有氧化性,二氧化硫具有还原性,被碘单质氧化为硫酸,本身被还原为碘化氢,反应的离子方程式为:SO
2+I
2+2H
2O=4H
++2I
-+SO
42-,故答案为:SO
2+I
2+2H
2O=4H
++2I
-+SO
42-;
(2)将足量的SO
2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应:
A、氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,故A不符合;
B、稀盐酸加入后不反应,故B符合;
C、加入硝酸钾溶液,硝酸根和氢离子形成稀硝酸具有氧化性,能氧化二氧化硫为硫酸,硫酸根和钡离子生成沉淀,故C不符合;
D、加入硫化钠溶液,硫离子具有还原性,二氧化硫具有氧化性,会反应氧化还原反应,生成硫单质,故D不符合;
故答案为:B.
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3,所以X中S和O的原子个数比为
:
=3:2,所以该离子为S
2O
3 2-;氯气有强氧化性,能和硫代硫酸根离子发生氧化还原反应,根据题意知,该反应中有硫酸根离子生成,所以氯气中氯元素得电子生成氯离子,所以该反应的离子方程式为:4Cl
2+S
2O
32-+5H
2O=2SO
42-+8Cl
-+10H
+,
故答案为:4Cl
2+S
2O
32-+5H
2O=2SO
42-+8Cl
-+10H
+;
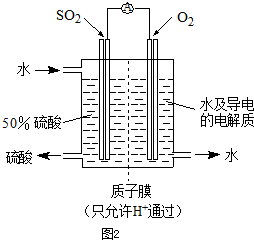
(4)该原电池的本质是2SO
2+O
2+2H
2O=2H
2SO
4,SO
2在负极上发生氧化反应电极反应式为SO
2-2e
-+2H
2O═SO
42-+4H
+,O
2在正极上发生还原反应电极反应式为O
2+4e
-+4H
+═2H
2O;
故答案为:负;SO
2-2e
-+2H
2O═SO
42-+4H
+;2SO
2+O
2+2H
2O=2H
2SO
4;
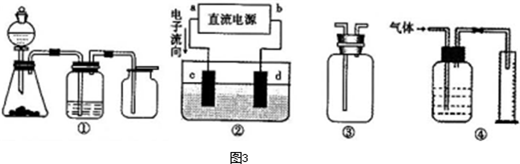
Ⅱ、A.因NO有毒,不能排放在空气中,应有尾气处理装置,则装置不能完成铜屑与稀硝酸的实验,故A错误;
B.电子由负极流向正极,所以装置②中a为负极,故B错误;
C.装置③中气体长进短出,收集密度比空气大的气体;短进长出收集密度比空气小的气体,则装置③可用于收集H
2、NH
3、Cl
2、HCl、NO
2等,故C正确;
D.测量气体的体积,装液态的集气瓶中的导管应短进长出,则装置④不能用于测量气体体积的装置,故D错误;
故答案为:C;
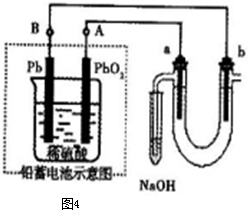
Ⅲ、铅蓄电池电解苦卤水,铅蓄电池放电时,电池反应式为Pb+PbO
2+2H
2SO
4=2PbSO
4+2H
2O,硫酸参加反应,所以溶液的pH值变大;
A、铅蓄电池放电时,负极上失电子发生氧化反应,电极反应式为:Pb-2e
-+SO
42-=PbSO
4,故A错误;
B、铅蓄电池放电时,较活泼的金属铅失电子发生氧化反应.二氧化铅得到电子发生还原反应,因为两个电极均生成PbSO4,所以A极、B极都增重,故B错误;
C、铅蓄电池充电时,阳极与电源正极相连,即B极应与外电源正极相连,故C错误;
D、电解苦卤水时,a为阳极,溶液中溴离子失电子生成溴单质,故D正确;
故答案为:D.