
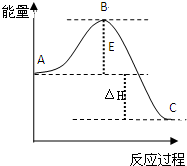
 SO2(g)+
SO2(g)+| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、乙烯的结构简式:CH2CH2 |
B、丙烯的键线式: |
| C、一定条件下,某密闭容器中充入2molSO2(g)和1molO2(g),达到平衡后,放出QkJ热量,则其热化学方程式为:2SO2(g)+O2(g)═2SO3(g )△H=-QkJ?mol-1 |
| D、甲烷的标准燃烧热△H=-890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含有大量Al3+的溶液中:K+、Na+、Cl-、HCO3- |
| B、在NaCl溶液中:NH4+、K+、CH3COO-、I- |
| C、0.2mol/L的FeCl3溶液中:NH4+、K+、Br-、SCN- |
| D、pH=1的溶液中:NO3-、SO42-、Na+、Pb2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol 苯中含有碳碳双键的数目为3NA |
| B、28g乙烯所含共用电子对数目为2NA |
| C、1mol-CH3(甲基)中含有电子数为8NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、沼气、风能、太阳能 |
| B、水能、生物能、天然气 |
| C、煤炭、石油、地热能 |
| D、潮汐能、海洋能、核能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com