
| X | Y | ||
| Z | W |
| A、原子半径Z>W>Y |
| B、最高价氧化物对应水化物的酸性Z>W |
| C、氢化物的稳定性X>Z |
| D、X的氢化物与Y的氢化物能发生化合反应生成离子化合物 |


科目:高中化学 来源: 题型:
| A、3.01×1023 |
| B、4.816×1023 |
| C、6.02×1023 |
| D、1.204×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:
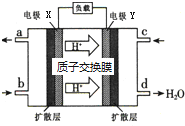 绿色电源“二甲醚-氧气燃料电池”的工作原理如图,
绿色电源“二甲醚-氧气燃料电池”的工作原理如图,查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2是一种酸性氧化物 |
| B、碳氧两种元素只能组成CO2 |
| C、干冰的主要成份是CO2 |
| D、固态CO2的密度比气态CO2的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b点无BaSO4沉淀生成 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol任何气体的体积都是22.4 L |
| B、2 mol氯化钠固体溶解于1 L水所得盐酸物质的量为2 mol/L |
| C、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| D、32 g O2中含有氧原子数为1.204×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠是处理废水中含上述金属离子的沉淀剂 |
| B、在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜 |
| C、在含Hg2+、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当c(S2-)=0.001 mol?L-1时三种金属离子都完全沉淀 |
| D、向含Pb2+、Cu2+、Hg2+的浓度均为0.010 mol?L-1的溶液中通人硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
| B、等物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3?H2O,c(NH4+)由大到小的顺序是:①>②>③>④ |
| C、a mol?L-1 HCN溶液与 a mol?L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则c(OH-)<c(H+) |
| D、0.1 mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com