
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料。具有较强的还原性,可用于棉织物漂白后的脱氯剂,定量分析中的还原剂。易溶于水,不溶于乙醇。Na2S2O35H2O于40~45℃熔化,48℃分解。实验室中常用亚硫酸钠和硫磺制备Na2S2O35H2O。制备原理为:Na2SO3+S+5H2O═Na2S2O35H2O。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
Ⅰ.实验室制取Na2S2O35H2O晶体的步骤如下:
①称取12.6 g Na2SO3于烧杯中,溶于80.0 mL水。
②另取4.0 g硫粉,用少许乙醇润湿后,加到上述溶液中。
③水浴加热(如图1所示,部分装置略去),微沸,反应约1小时后过滤。
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O35H2O晶体。
⑤进行减压过滤(如图2所示)、乙醇洗涤并干燥。请回答:
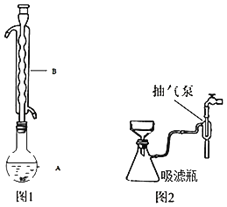
(1)仪器B的名称是_____。
(2)步骤④在浓缩过程中不能蒸发过度,其原因是_____。步骤⑤如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是_____。
(3)洗涤时为尽可能避免产品损失应选用的试剂是_____。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
Ⅱ.设计以下实验流程探究Na2S2O3的某些化学性质
![]()
(4)实验①Na2S2O3溶液pH=8的原因是_____(用离子方程式表示)。
(5)写出实验②中发生的离子反应方程式_____。
Ⅲ.用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验。
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1 ML试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I﹣+H+—I2+Cl﹣+H2O 未配平)。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。
(6)滴定终点现象是_____。根据上述步骤计算出原ClO2溶液的物质的量浓度为_____ mol/L(用含字母的代数式表示)。
【答案】球形冷凝管 避免温度高于48℃,Na2S2O35H2O发生分解 避免发生水倒吸 B S2O32﹣+H2OHS2O3﹣+OH﹣ S2O32﹣+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl﹣+10H+ 溶液蓝色褪去,并在半分钟内不恢复 ![]()
【解析】
(1)、根据装置图可知,仪器B为球形冷凝管;
(2)、根据题干信息‘Na2S2O35H2O于40~45℃熔化,48℃分解’解答;停止抽滤时,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,是为了避免发生水倒吸;
(3)、硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中,硫在酒精中微溶,可以增大接触面积,提高反应速率;
(4)、常温下,由pH=8,是Na2S2O3为强碱弱酸盐,水解呈碱性;
(5)、加入足量氨水同时加入氯化钡溶液,氯水具有氧化性,Na2S2O3具有还原性,发生氧化还原反应,生成SO42-和Cl-,生成的SO42-再与Ba2+反应;
(6)、滴定终点时Na2S2O3溶液将碘全部还原,以淀粉溶液作指示剂,溶液蓝色褪去;由方程式2ClO2+10I- +8H+=5I2+2Cl-+4H2O、I2+2S2O32-=2I-+S4O62-得关系式ClO2~52S2O32-, n (2S2O32-) =cV2×10-3mol,所以V1mL ClO2的溶液中含有的ClO2的物质的量为2cV2×10-4mol,根据c=![]() 计算出原ClO2溶液的物质的量浓度。
计算出原ClO2溶液的物质的量浓度。
(1)由装置图可知仪器B为球形冷凝管,故答案为:球形冷凝管;
(2)加热时应避免温度高于48℃,Na2S2O35H2O发生分解,抽滤时应避免倒吸,如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是避免发生水倒吸,
故答案为:避免温度高于48℃,Na2S2O35H2O发生分解;避免发生水倒吸;
(3)洗涤时为尽可能避免产品损失应选用乙醇,故答案为:B;
(4)Na2S2O3为强碱弱酸盐,水解呈碱性,离子方程式为S2O32﹣+H2OHS2O3﹣+OH﹣,
故答案为:S2O32﹣+H2OHS2O3﹣+OH﹣;
(5)实验②中发生的离子反应方程式为S2O32﹣+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl﹣+10H+,
故答案为:S2O32﹣+5H2O+4Cl2+2Ba2+=2BaSO4↓+8Cl﹣+10H+;
(6)滴定终点,溶液蓝色褪色,且半分钟内不恢复,反应的关系式为2ClO2~5I2~10S2O32﹣,n(Na2S2O3)=V2c×10﹣3mol,则c(ClO2)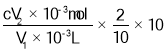 =
=![]() mol/L,
mol/L,
故答案为:溶液蓝色褪去,并在半分钟内不恢复;![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4B.CH4 C3H6
C.C2H4 C3H4D.C2H4 CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
某化学兴趣小组将上述流程②③设计成如图所示:
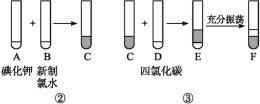
已知②中发生反应的化学方程式为Cl2+2KI![]() 2KCl+I2。
2KCl+I2。
回答下列问题:
(1)写出提取过程①③中实验操作名称:①____,③____。
(2)四氯化碳是____色、密度比水的密度____的液体。F中下层液体的颜色为____色,上层液体中溶质的主要成分为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
①SO2、CS2、HI都是直线形的分子 ②价电子排布式为ns2的原子属于ⅠA或ⅡA族元素 ③Ge是ⅣA族的一种元素,其核外电子排布式为:[Ar]4s24p2,属于P区元素 ④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子⑤化合物NH4Cl和CuSO4·5H2O都存在配位键 ⑥AgCl是一种白色的沉淀,不溶于硝酸、浓硫酸、烧碱溶液,却能溶于氨水中 ⑦已知熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,则从不同角度分类HgCl2是一种共价化合物、非电解质、盐、分子晶体 ⑧氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为![]()
A.①③B.②④C.⑤⑥D.⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ΔH = -890.3 kJ·mol-1
B.500C、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = -38.6 kJ·mol-1
2NH3(g) ΔH = -38.6 kJ·mol-1
C.向明矾溶液中加入过量的氢氧化钡溶液:Al3+ + 2SO42-+ 2Ba2+ + 4OH- = 2BaSO4↓+ 2H2O + AlO2-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5 O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于酯化反应的是( )
A.CH4 + Cl2 ![]() CH3Cl + HCl
CH3Cl + HCl
B.CH2 = CH2 + Br2![]() CH2BrCH2Br
CH2BrCH2Br
C.nCH2 = CH2 ![]()
![]()
D.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个农业大国,农业是立国之本,化肥与农药的发展对农业起着巨大的推动作用。请回答下列问题:
(1)农作物生长过程中不可缺少的微量元素有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质形成和新陈代谢不可缺少的元素。常用铜肥是胆矾,在盐碱地(土壤
等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质形成和新陈代谢不可缺少的元素。常用铜肥是胆矾,在盐碱地(土壤![]() )施用胆矾时宜将溶液_____________(填“喷在叶片上”或“随水灌人土壤中”),原因是_______________________。
)施用胆矾时宜将溶液_____________(填“喷在叶片上”或“随水灌人土壤中”),原因是_______________________。
(2)农药波尔多液是一种常用的杀菌剂,常用配方为硫酸铜、熟石灰、水,三者按一定质量比混合,分析其防治病虫害的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100 mL 0.1 molL-1 NH4HSO4溶液中滴加0.1 molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )

A. a点时溶液的pH<1
B. c点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)
C. de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42-)
D. a点到b点的过程中,溶液的导电能力增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com