
【题目】用40gNaOH固体溶于水配制成250ml溶液,此溶液的物质的量浓度是____,取该溶液10ml,再加水稀释成100ml时,所得稀溶液的物质的量浓度为___,在这100ml溶液中含____g。
科目:高中化学 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
N在元素周期表中的位置:______________。
元素C、N最简单气态氢化物的稳定性强弱比较(填化学式): ____________.
I.氨气应用于侯德榜制碱工艺,原理如下图所示:
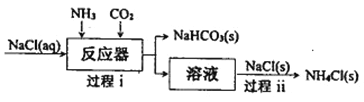
(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
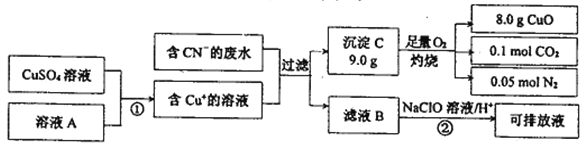
(1)溶液A具有的性质是(填“氧化性”或“还原性”) _______. C的化学式为:______。
(2)反应② 可将CN一转化为无害物质,其离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用CuSO4·5H2O晶体配制500 mL 0.1 mol·L-1 CuSO4溶液,回答下列问题:

(1)应该用托盘天平称取CuSO4·5H2O________g。
(2)如图Ⅰ表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为8,量筒中液体的体积是________mL。
(3)若实验中如图Ⅱ所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.定容前容量瓶底部有水珠__________________________;
B.定容时加水超过刻度线____________________________;
C.最终定容时俯视观察液面__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是:
A. 氢氧化铝与稀硝酸反应:H+ + OH- = H2O
B. MgCl2溶液与氨水反应: Mg2+ + 2NH3·H2O = Mg(OH)2↓+2NH![]()
C. CuCl2溶液与铁粉反应: 3Cu2+ + 2Fe =3Cu + 2Fe3+
D. 锌与CH3COOH溶液反应:Zn + 2H+ = Zn2++ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
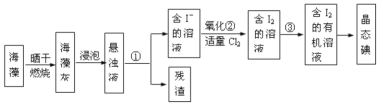
(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有______
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(3)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(4)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有下列键型的物质,可能为单质的是
A.只有离子键的物质B.既有离子键,又有非极性键的物质
C.既有极性键,又有离子键的物质D.只有非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量比为1:1的CO和H2组成的混合气体2.1 g在足量的氧气中点燃充分反应后,将产物立即通入足量的Na2O2固体中,固体质量增加为
A. 3.6 g B. 2.1g C. 7.2 g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝的碱式碳酸盐是中和胃酸药物的主要成分。欲测定某种镁和铝的碱式碳酸盐的成分进行了以下实验,根据以下实验记录,回答下列问题:
(1)称取6.02g该碱式碳酸盐,加入4.0mol/L盐酸使其溶解,当加入42.5mL时开始产生CO2,当加入盐酸至45.0mL时恰好完全溶解,该碱式碳酸盐中OH-与CO32- 的物质的量之比n(OH-)︰n(CO32-)=__________;
(2)在上述碱式碳酸盐恰好完全溶解所得溶液中加入过量的NaOH溶液,过滤,干燥(不分解)后得3.48g沉淀物。若该碱式碳酸盐中镁元素与氢元素的质量分数之比为6:1,试计算确定该碱式碳酸盐的化学式 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com