
| A. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| B. | 向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42- | |
| C. | 在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 | |
| D. | 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
分析 A.加入硫酸铜可使锌与稀硫酸的反应速率加快,是因为构成原电池加快反应速率;
B.可能生成AgCl沉淀;
C.电解过程中,阳极上不仅有铜还有其它金属失电子;
D.如能自发进行,应满足△H-T•△S<0.
解答 解:A.加入硫酸铜可使锌与稀硫酸的反应速率加快,是因为构成原电池加快反应速率,故A错误;
B.可能生成AgCl沉淀,应先加入盐酸,再加入氯化钡检验,故B错误;
C.电解过程中,阳极上不仅有铜还有其它金属失电子,如Zn等,则阳极质量的减少多于阴极质量的增加,故C正确;
D.因△S<0,如能自发进行,应满足△H-T•△S<0,则△H<0,故D正确.
故选CD.
点评 本题考查较为综合,涉及化学反应与能量变化、化学反应无论以及电解等知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SiC是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | 若生成4.48LCO,则转移0.4 mol 电子 | |
| D. | C 既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D216O的混合物中所含中子数为NA | |
| B. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| C. | 常温常压下50g 46%的乙醇溶液中,所含氧原子数目为0.5NA | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 40℃时,将35 g NaCl溶于100 g水中,降温至0℃时,可析出晶体 | |
| B. | 20℃饱和KNO3溶液的溶质质量分数>31.6% | |
| C. | a点KNO3和NaCl溶液的物质的量浓度相等 | |
| D. | 固体KNO3中混有NaCl,可用重结晶进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活污水使用明矾杀菌消毒 | B. | 向燃煤中加入适量石灰石“固硫” | ||
| C. | 推广使用可降解塑料防止白色污染 | D. | 提倡公交出行可减少氮氧化物排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用松花蛋时蘸些食醋可以去除氨味 | |
| B. | 用双氧水的稀溶液清洗伤口可以杀菌消毒 | |
| C. | 用淀粉溶液检验某食盐是否为加碘盐 | |
| D. | 长期使用含氟牙膏可预防龋齿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
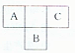 短周期元素A、B、C,在周期表中所处的位置如图所示、A、B、C三种元素原子质子数之和为32.D元素原子的最外层电子数为其次外层电子数的2倍.则下列说法正确的是( )
短周期元素A、B、C,在周期表中所处的位置如图所示、A、B、C三种元素原子质子数之和为32.D元素原子的最外层电子数为其次外层电子数的2倍.则下列说法正确的是( )| A. | A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| B. | A的气态氢化物比B的气态氢化物稳定,是由于A的氢化物分子间有氢键 | |
| C. | 元素D形成的气态氢化物一定是正四面体型分子 | |
| D. | 四种元素的原子半径:B>D>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
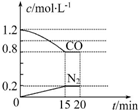 “霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com