
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用图示装置进行实验(夹持仪器已略去,气密性已检验)。

回答下列问题:
(1)仪器a的名称:___________________。
(2)打开弹簧夹1,关闭弹簧夹2,旋开仪器a的活塞滴加盐酸。一段时间后,A中现象是________;原因是________。
(3)关闭弹簧夹1,打开弹簧夹2,D中出现白色胶状沉淀,X是________(填化学式),D中发生反应的化学方程式是___________________。
【答案】分液漏斗 有白色沉淀生成 生成CO2气体中混有HCl气体 NaHCO3 Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓或Na2SiO3+2H2O+2CO2=2NaHCO3+H2SiO3↓
【解析】
盐酸与CaCO3发生复分解反应产生CO2气体,盐酸具有挥发性,可通过将气体通入到硝酸酸化的AgNO3溶液产生白色沉淀检验气体中HCl的存在;要证明碳酸的酸性比硅酸强,在将CO2气体通入硅酸钠溶液前,应该先用饱和NaHCO3溶液除去HCl杂质,然后再进行检验,若产生白色沉淀,说明碳酸酸性比硅酸强,据此解答。
(1)根据图示可知仪器a的名称是分液漏斗;
(2)打开弹簧夹1,关闭弹簧夹2,旋开仪器a的活塞滴加盐酸。一段时间后,A中现象是产生白色沉淀,这是由于盐酸具有挥发性,在制取得到的CO2气体中含有杂质HCl气体,发生反应:HCl+AgNO3=AgCl↓+HNO3,得到白色AgCl沉淀;
(3)关闭弹簧夹1,打开弹簧夹2,在C中杂质HCl与NaHCO3发生反应:HCl+NaHCO3=NaCl+CO2↑+H2O,这样既除去了杂质l,同时也反应产生了CO2气体,然后在装置D中发生反应:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓或Na2SiO3+2H2O+2CO2=2NaHCO3+H2SiO3↓,因此看到装置D中出现白色胶状沉淀,证明酸性:H2CO3>H2SiO3,从而说明了元素非金属性:碳比硅强。


科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.某温度下,1 L pH = 6 的纯水中含 OH一为10-8mol
B.25℃ 时,向0. 1 mo lL-1 CH3COONa 溶液中加入少量水,溶液中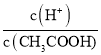 减小
减小
C.25℃时,将 V1 L pH = 11的 NaOH溶液与V2 L pH = 3 的H A 溶液混合,溶液显中性,则V1 ≤V2
D.25℃时,将 a molL-1 氨水与0.01 molL- 1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示 NH3H2O)的电离常数 Kb = ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生验证浓硫酸性质的实验如图。下列叙述错误的是

A.反应一段时间后,b处滤纸条褪色
B.蘸有NaOH溶液的棉花团作用是吸收多余的SO2,防止污染空气
C.化学反应方程式:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
D.硫酸型酸雨形成的可能原因是:SO2+H2O![]() H2SO3;O2+2H2SO3=2H2SO4
H2SO3;O2+2H2SO3=2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
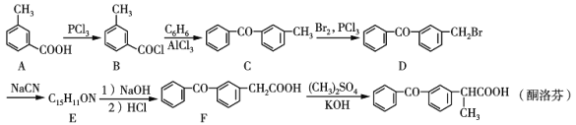
(1)化合物D中所含官能团的名称为___和____。
(2)化合物E的结构简式为__________;由B→C的反应类型是____
(3)写出C→D的反应方程式:_____________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有____种。
Ⅰ.属于芳香族化合物 Ⅱ.能发生银镜反应Ⅲ.其核磁共振氢谱有5组峰,且面积比为1∶1∶1∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2。在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
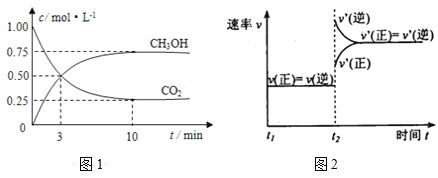
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(2)500℃该反应的平衡常数为_____(结果保留一位小数),图2是改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是_______。
A 在原容器中再充入1mol H2 B 在原容器中再充入1molCO2
C 缩小容器的容积 D 使用更有效的催化剂 E 将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)____ v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L 的密闭容器中,X、Y、Z 三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
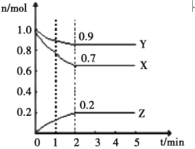
(1)2min时,Y 的物质的量浓度是____________;
(2)从开始至2min,X 的平均反应速率为_________;
(3)该反应的化学方程式为____________________;
(4)1min时,v(正)____v(逆),2min时,v(正)____v(逆) (填“>”或“<”或“=”);
(5)在2min时,向容器中通入氩气,增大体系压强,X 的化学反应速率将______;
(6)2min时,x的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com