
分析 同温同压下,等体积的气体具有相同的物质的量,结合N=nNA计算出二者的分子数、原子数之比,然后根据m=nM计算出二者的质量之比.
解答 解:同温同压下,气体摩尔体积相等,则等体积O2和O3的物质的量相等,根据N=nNA可知O2和O3所含分子个数比为1:1,含有原子数之比为(1×2):(1×3)=2:3;
由于二者的物质的量相等,根据m=nM可知,二者的质量之比等于其摩尔质量之比,所以二者质量之比为:32g/mol:48g/mol=2:3,
故答案为:1:1;2:3;2:3.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

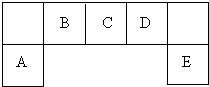
| A. | 每个去甲肾上腺素分子中含有 3 个酚羟基 | |
| B. | 去甲肾上腺素分子难溶于水 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、NO3-、I- | B. | H+、Ag+、NO3-、HCO3- | ||
| C. | Fe3+、Na+、S2-、Cl- | D. | Al3+、K+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| B. | 石油分馏得到的汽油、煤油、柴油等各种沸点范围不同的混合物 | |
| C. | 通过石油裂化和裂解可以获得轻质油和重要化工原料(乙烯、丙烯等) | |
| D. | 天然气和沼气的主要成分是甲烷,它们都属于不可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
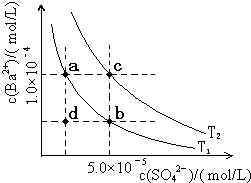 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:查看答案和解析>>
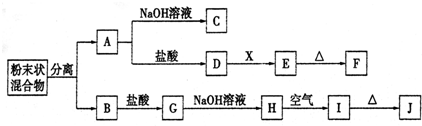
科目:高中化学 来源: 题型:推断题
 ,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,该阳离子中存在的化学键有极性共价键,并写出该阳离子与F的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com