
【题目】含锌废渣及粉尘是危险废物,碱浸电解法处理可得锌粉。但若其中存在氯,则锌质量就严重下降,对电极板也有严重腐蚀作用。工业上模拟碱浸电解法处理含锌质量分数为16%的废料(主要成分为ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu杂质)工艺如图:
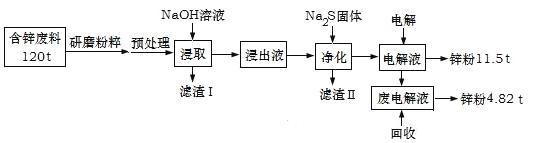
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子
ⅱ.滤渣Ⅱ的主要成分为:Na2Pb(OH)xS![]()
(1)从物质分类的角度看,ZnO属于__,其与NaOH溶液发生反应的离子方程式为__。
(2)“滤渣Ⅰ”的主要成分为___。
(3)下表是“预处理”的2种除氯方案中粉尘氯的去除率和锌损失率分析表格可知,首选的“除氯剂”为___,原因是____。
除氯剂 | 碱(NaOH) | 碳酸钠 |
氯去除率/% | 78.75 | 83.69 |
锌损失率/% | 0.26 | 0.28 |
价格/t | 7200元 | 3600元 |
(4)“电解”过程中阴极的电极反应式为____。
(5)锌的总回收率为____。
【答案】两性氧化物 ![]() Fe2O3、Cu 碳酸钠 碳酸钠既能达到很好除氯效果又不会引起较大的锌损失,且比NaOH价格便宜
Fe2O3、Cu 碳酸钠 碳酸钠既能达到很好除氯效果又不会引起较大的锌损失,且比NaOH价格便宜 ![]() 85%
85%
【解析】
(1)ZnO既可以和酸反应,又可以和碱反应从物质分类的角度看,属于两性氧化物,其与NaOH溶液发生反应的离子方程式为![]() 。
。
(2)由于浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子,所以“滤渣Ⅰ”的主要成分为Fe2O3、Cu。
(3)分析表格可知,首选的“除氯剂”为碳酸钠,原因是碳酸钠既能达到很好除氯效果又不会引起较大的锌损失,且比NaOH价格便宜。
(4)“电解”过程产物为锌粉,[Zn(OH)4]2-在阴极得电子产生锌单质,电极反应式为![]() 。
。
(5)废料中含锌的总质量=120t![]() 16%=19.2 t,通过流程共回收锌的质量=11.5 t+4.82 t=16.32 t,锌的总回收率=
16%=19.2 t,通过流程共回收锌的质量=11.5 t+4.82 t=16.32 t,锌的总回收率=![]() =85%
=85%


科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:

填写下列空白:
(1)甲中不含氧原子的官能团是___;下列试剂能与甲反应而褪色的是___(填字母)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:____。
(3)已知:C2H5Br+NaOH![]() CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
CH3CH2OH+NaBr,淀粉通过下列转化可以得到乙(CH2OHCH2OH):
淀粉![]() A
A![]() B(C2H5OH)
B(C2H5OH)![]() C(C2H4)
C(C2H4)![]() D(C2H4Br2)
D(C2H4Br2)![]() 乙
乙
①A的分子式是____,试剂X可以是_____。
②写出由D生成乙化学方程式:_______。
(4)已知:
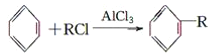 +HCl(-R为羟基)
+HCl(-R为羟基)
 +H2
+H2
根据已有知识并结合相关信息,写出以苯、乙烯、氯化氢为原料制备丙的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3______。
CH3COOCH2CH3______。
(5)写出丙在引发剂的条件下生成高分子化合物的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
①金刚石与“足球烯”、C60;②氧气(O2)与臭氧(O3);③16O、17O和18O;④CH4和CH3CH2CH3;
⑤乙烯和乙烷;⑥![]() 和
和![]() ;⑦
;⑦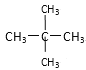 和
和![]() ;
;
(1)同位素___,
(2)同系物___,
(3)同分异构体___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:


①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(“增大”或“减小”)。
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的ΔH______0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为__________________;平衡时混合气体中NO2的体积分数为_______。
②100℃时达平衡后,向容器中迅速充入含0.08mol的NO2和0.08mol N2O4 的混合气体,此时速率关系v(正)____v(逆)。(填“大于”,“等于”,或“小于”)
③100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a.T________100℃(填“大于”或“小于”),判断理由是____________________
b.列式计算温度T时反应的平衡常数K2(写计算过程):______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速伸入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2g。实验时由于所伸入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
A.NaOH溶液,W1=W2B.NaHSO4溶液,W1<W2
C.无水乙醇,W1=W2D.CO,W1>W2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从本质入手看物质及其能量的变化,可以让我们更加深入的去理解所学知识的内涵及外延应用。对于《原电池》这部分知识也是如此,如图是原电池的基本构造模型:

(1)若a和b的电极材料为Al或Mg。
①若c为稀NaOH溶液时,则a的电极材料为__,该极电极方程式为___。
②若c为稀H2SO4时,则a的电极材料为___,该极电极方程式为__。
(2)对于原电池的应用,以下说法正确的是__。
A.选择构成原电池两极材料时,必须选择活泼性不同的两种金属材料
B.构成原电池时,负极材料的活泼性一定比正极材料的强
C.构成原电池时,作为负极材料的金属受到保护
D.从能量转化角度去看,如图的氧化还原反应能量变化曲线,则不能够设计原电池

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com