

分析 废铁屑中含有酯类油污,Na2CO3为强碱弱酸盐,CO32-水解生成HCO3-和OH-,升高促进CO32-水解,碱促进油脂水解,然后过滤洗涤,加入稀硫酸,加热发生反应为:Fe+H2SO4=FeSO4+H2↑,趁热过滤、冷却结晶,过滤洗涤得到FeSO4•7H2O;
(1)碳酸钠溶液能除去油污是因为碳酸根离子水溶液中水解显碱性;
(2)分析可知操作a为趁热过滤减少晶体溶解;
(3)操作中得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
将补血剂研细,向药片中加入稀硫酸,然后过滤得到沉淀,向滤液中加入双氧水,发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,向溶液中加入过量X溶液生成红褐色沉淀,则X为碱,将红褐色沉淀灼烧得到红棕色固体Fe2O3,据此分析解答,
(4)①溶液中得到沉淀的方法是过滤、洗涤、干燥、灼烧、冷却、称量等操作;
②ag固体为氧化铁,结合铁元素守恒计算;
③若步骤③加入X溶液的量不足,生成氢氧化铁沉淀减少;
解答 解:(1)铁屑与稀硫酸反应前,应用10%Na2CO3溶液浸泡几分钟,溶液中碳酸根离子水溶液中水解显碱性;反应的离子方程式为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,操作目的是碳酸钠溶液能除去油污,故答案为:除去废铁屑表面的油污;
(2)为减少晶体损失,操作a为趁热过滤,
故答案为:趁热过滤;
(3)最后得到的绿矾晶体用少量冰水洗涤,温度降低物质溶解度减小,所以其目的是:①除去晶体表面附着的硫酸等杂质,②减少洗涤过程中FeSO4•7H2O的损耗,
故答案为:减少洗涤过程中FeSO4•7H2O的损耗;
(4)①步骤④中一系列操作依次是:①过滤、②洗涤、③灼烧、④冷却、⑤称量、⑥恒重操作确保氢氧化铁完全分解成了氧化铁,
故答案为:灼烧;
②ag固体为氧化铁,固体中m(Fe)=$\frac{112g}{160g/mol}$×ag=0.7ag,则每片药品中Fe的质量为0.07ag,
故答案为:0.07a;
③若步骤③加入X溶液的量不足,生成氢氧化铁沉淀减少,则最后测出每片补血剂含铁元素的质量将偏小,
故答案为:偏小.
点评 本题考查物质的分离和提纯、物质含量的测定,侧重考查分析、计算、基本操作能力,明确每一步发生的反应是解本题关键,知道物质分离和提纯的基本方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 蔗糖与浓硫酸混合产生刺激性气味的气体 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| D. | 向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:Na+、Fe2+、Cl-、SO42- | |
| B. | 含有NaOH的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 能与Al反应生成H2的溶液:NH4+、K+、NO3-、Cl- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,明矾,烧碱 | B. | 同素异形体:C60,石墨,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:纯净矿泉水,盐酸,漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
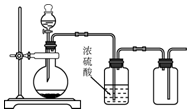
| A. | 用锌和稀硫酸制备H2 | B. | 用铜和稀硝酸制备NO | ||
| C. | 用30%H2O2水溶液和MnO2制备O2 | D. | 用MnO2和浓盐酸制备Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个隔离的不同半电池通过盐桥连接可以组成原电池 | |
| B. | 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 | |
| C. | 在铁上镀银,用银作阳极 | |
| D. | 牺牲阳极的阴极保护法利用的是原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 析氢腐蚀 | B. | 吸氧腐蚀 | C. | 化学腐蚀 | D. | 置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com