

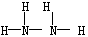 (2分) 正四面体 (1分)② 1.5mol(2分)
(2分) 正四面体 (1分)② 1.5mol(2分)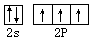 (2分)。
(2分)。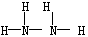 。由于在NH4+中氮原子的4个价电子全部参与成键,不存在孤对电子,所以NH4+的空间构型是正四面体结构。
。由于在NH4+中氮原子的4个价电子全部参与成键,不存在孤对电子,所以NH4+的空间构型是正四面体结构。 。
。

科目:高中化学 来源:不详 题型:单选题
| A.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以Al(OH)3的形式存在 |
| C.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液,电池工作时溶液中的阴离子移向正极 |
| D.能通过化合反应制得FeCl2和Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
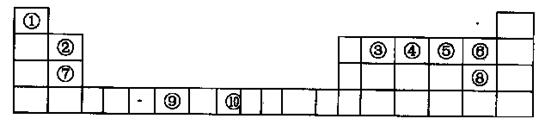
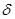 键与
键与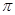 键的个数比为 。
键的个数比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x 值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com