
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 提取溴水中的溴:加入适量乙醇,振荡、静置、分液 | |
| D. | 用结晶、重结晶除去KNO3中的少量NaCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3中含有的3个N-H键是等同的 | B. | NH3中N-H键之间的夹角为107°18′ | ||
| C. | NH3分子空间构型为三角锥形 | D. | NH3的熔点比水的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24.32kg | B. | 30kg | C. | 25.3kg | D. | 4.08kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100mL溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色固体 | 1.248 | 133 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
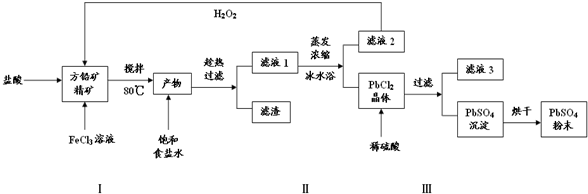
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com