
| A. | 熔化状态下能导电的物质一定是离子化合物 | |
| B. | 单质分子中一定含有共价键 | |
| C. | 只由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键只存在极性键 |
分析 A.熔融状态下能导电的物质可能是金属单质;
B.单质分子中可能不含化学键;
C.只由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物;
D.不同元素组成的多原子分子里的化学键存在极性键,也可能含有非极性键.
解答 解:A.熔融状态下能导电的物质可能是金属单质,如Cu等,故A错误;
B.单质分子中可能不含化学键,稀有气体中不含化学键,只含分子间作用力,故B错误;
C.只由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,故C正确;
D.不同元素组成的多原子分子里的化学键存在极性键,也可能含有非极性键,如多碳原子的烃等,故D错误;
故选C.
点评 本题考查离子化合物、化学键的关系,为高频考点,明确物质中存在的化学键及物质构成微粒是解本题关键,采用举例法分析解答,易错选项是B.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
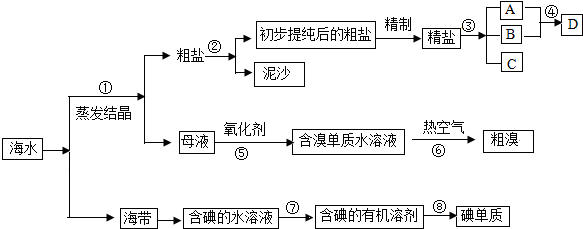
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
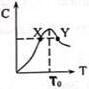 将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
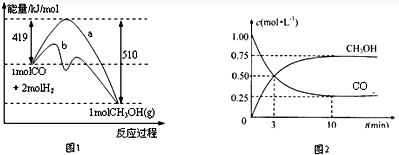
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生 | |
| B. | 无论是风力发电还是火力发电,都是将化学能转化为电能 | |
| C. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| D. | 硫的氧化物和氮的氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 6MgO+4Al$\frac{\underline{\;\;△\;\;}}{\;}$6Mg+2Al2O3 | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的生成速率与C分解的速率相等 | |
| B. | 单位时间生成nmolA,同时生成3nmolB | |
| C. | 单位时间生成nmolA,同时生成2nmolC | |
| D. | 单位时间生成B的速率与生成C的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Cl2通入水中 Cl2+H2O?2H++ClO-+Cl- | |
| D. | 向浓盐酸中加二氧化锰:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com