
mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是
qC(g);ΔH<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是
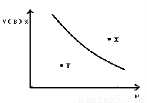
A、m+n<qB、X点时的状态,V正>V逆
C、n<qD、X点比Y点混和物的正反应速率慢
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届陕西省高三月考二化学试卷(解析版) 题型:实验题
某学生化学课外兴趣小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,进行了下列实验探究。
【提出假设】
假设1:沉淀为CuCO3;
假设2:沉淀为 ;
假设3:沉淀为碱式碳酸铜[化学式可表示为nCu(OH)2·mCuCO3]。
【查阅资料】这三种沉淀受热均易分解,都生成黑色固体CuO。
【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如下装置(夹持仪器未画)进行定性实验;
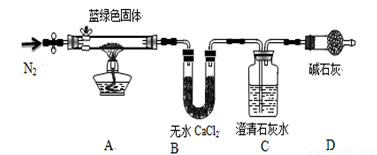
【问题讨论】
(1)假设2中的沉淀为 ,提出该假设的理论依据是 ,
(2)步骤1用无水乙醇洗涤,再风干的目的 ,
(3)装置D装有碱石灰的干燥管所起的作用是 ,
(4)若反应后A中蓝绿色固体变黑,C中澄清石灰水变浑浊,证明假设 (填写序号)一定不成立
(5)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,通过观察便可验证上述所有假设,该试剂是 (填代号)
A.浓硫酸 B.无水CuSO4 C.碱石灰 d.P2O5
(6)该小组经试验确定假设3成立,他们想进一步测定蓝绿色固体的化学式,丙同学查得一些物质在20℃的数据(如下表)后,建议将C中的澄清石灰水改为Ba(OH)2溶液,其原因是 (双选,填代号)
溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
(7)作上述调整后,若所取蓝绿色固体质量为27.1g,实验结束后装置B中无水氯化钙的质量增加2.7g,C中氢氧化钡溶液里产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为 ,
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄一中高二上期中考试化学试卷(解析版) 题型:选择题
以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如右图所示。下列说法不正确的是
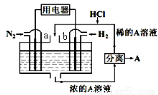
A.b电极为负极,发生氧化反应
B.a电极发生的反应为N2+8H++6e﹣=2NH4+
C.A溶液中所含溶质为NH4Cl
D.当反应消耗1molN2时,则消耗的H2为67.2L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄一中高二上期中考试化学试卷(解析版) 题型:选择题
下列有机物不能通过加成反应制取的是
A.CH3CH2Cl
B.CH2ClCH2Cl
C.CH3CH2OH
D.CH3COOH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:填空题
在100℃时,将0.200mol的四氧化二氮气体充入 2L真空的密闭容器中,每隔一定的时间对该
2L真空的密闭容器中,每隔一定的时间对该 容器内的物质进行分析,得到如下表格:?
容器内的物质进行分析,得到如下表格:?
时间min 浓度mol/L | 0 | 2 | 4 | 6 | 8 | 10 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:?
(1)该反应达到平衡时,四氧化二氮的转化率为 %,表中c2 c3、a b(填“>”、“<”或“=”)。
(2)2min时四氧化二氮的浓度c1=mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为 mol/(L·min)。
(3)100℃时,该反应的平衡常数K=
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol/L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
在一恒温恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
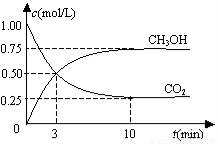
A.反应进行到3min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.第3min时,氢气的平均反应速率为1.5mol/(L·min)
D.该温度下,反应的平衡常数的值为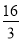
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州铜仁市高二上期中考试化学试卷(解析版) 题型:选择题
下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强(体系体积减小),可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃静宁一中高一上月考二化学试卷(解析版) 题型:选择题
下列各项所述的关系正确的是
A.有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外在表现
B.一种物质被氧化,必然有另一种物质被还原
C.被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子
D.氧化反应就是得到或偏向电子的反应,还原反应就是失去或偏离电子的反应
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、六合等七校高三上期中化学试卷(解析版) 题型:填空题
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
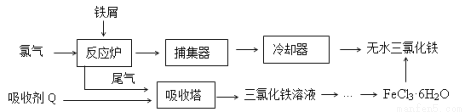
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com