
【题目】下列叙述中正确的是
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaOH溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:1
C.等物质的量的NaHCO3和Na2CO3分别与足量盐酸反应,同温同压下,生成的CO2体积不相同
D.分别向NaHCO3溶液和Na2CO3溶液中加入Ca(OH)2溶液,只有Na2CO3溶液产生沉淀
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A | B | C | D | |
装 置 |
|
|
|
|
目的 | 证明AlCl3是共价化合物 | 证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成 | 证明氯气氧化性强于I2 | 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
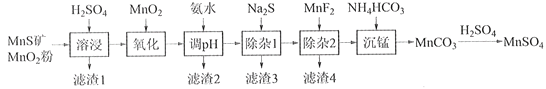
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMn![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:

下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、A1等,处理该废料的一种工艺如下图所示:

回答下列问题:
(l) Li的原子结构示意图为____,LiCoO2中Co的化合价是____。
(2)“碱浸”时Al溶解的离子方程式为________。
(3)“酸溶”时加入H2O2的目的是____,调节pH后所得滤渣主要为____。
(4)“沉钴”的离子方程式为________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要____。
(6)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用 CO 或 CO2 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三 个化学反应进行了探究。已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是_____(填“吸热”或“放热”)反应;反应③的平衡常数表达式为 K=_____;
(2)根据反应①与②可推导出 K1、K2 与 K3 之间的关系,则 K3=_____(用 K1、K2 表示);根据反应③判断ΔS_____(填“>”“=”或“<”)0,在_____(填“较高”或“较低”)温度下有利于该反应自 发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有___________ (填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.从平衡体系中及时分离出 CH3OH
(4)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为 0.1 mol·L-1、0.8 mol·L-1、0.3 mol·L-1、0.15 mol·L-1,则此时 v(正)__________ v(逆)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因 ( 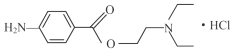 ) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
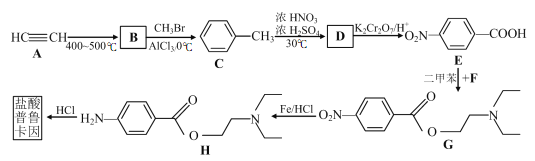
回答下列问题:
(1) 3molA可以合成1molB, 且B是平面正六边形结构, 则B的结构简式为_________。
(2) 有机物C的名称为____________, B→C的反应类型为_____________。
(3) 反应C→D的化学方程式为________________________________________。
(4) F和E发生酯化反应生成G, 则F的结构简式为___________________。
(5) H的分子式为____。
(6) 分子式为C9H12且是C的同系物的同分异构体共有__________种。
(7) 请结合上述流程信息, 设计由苯、 乙炔为原料合成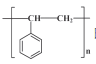 的路线_______________ 。(其他无机试剂任选)
的路线_______________ 。(其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下图所示仪器装置设计一个包括电解饱和食盐水并测定电解时产生的氢气的体积 和检验氯气的氧化性的实验装置。
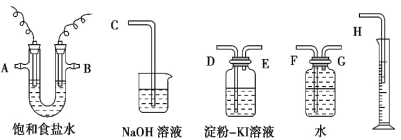
(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母):A 接_____,_____接_____,B接_____,_______接_____________。
(2)实验时用石墨和铁为电极,则铁电极接电源的_____极,所发生的电极反应式为_____; 此电解总反应方程式为_____。
(3)实验测得产生的氢气体积(已折算成标准状况)为 5.60 mL,电解后溶液的体积恰好为 50.0 mL, 则溶液中 OH-的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com