
下列各物质的物质的量不能肯定是1 mol的是
A.23 g金属钠所含的钠原子数
B.标准状况下,17 g氨气
C.22.4 L CO2气体
D.标准状况下10 L氧气和12.4 L氮气的混合物
科目:高中化学 来源:2015-2016学年江苏省盐城市高二上学期期中考试化学试卷(解析版) 题型:填空题
下列常用物质: A 碳酸氢钠 B 阿司匹林 C 葡萄 糖 D 苯甲酸钠 E 柠檬黄 请用字母填空:
糖 D 苯甲酸钠 E 柠檬黄 请用字母填空:
具有解热镇痛疗效的是 ;可直接进入人体血液补充能量的是 ;可用作食品防腐剂的是 ;常用作食品着色剂的是 ;常用作治疗胃酸过多的抗酸剂的是 ,写出该抗酸药发挥功效时的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南宁远一中、祁阳一中高二上第二次联考化学试卷(解析版) 题型:选择题
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol· L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1 
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
将一定量的SO2通入Ca(ClO)2溶液中,下列反应的离子方程式一定错误的是
A.SO2+H2O+Ca2++2ClO-====CaSO3↓+2HClO
B.SO2+H2O+Ca2++2ClO-====CaSO4↓+HClO+H++Cl-
C.2SO2+2H2O+Ca2++2ClO-====CaSO4↓+4H++2Cl-+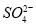
D.SO2+H2O+Ca2++3ClO-====CaSO4↓+2HClO+Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列离子能在无色澄清溶液中共存的是:
A.Fe3+、NO3-、K+、Cl- B.NH4+、Mg2+、SO42-、Cl-
C.Na+、Al3+、OH-、CO32- D. K+、Na+、NO3-、MnO4-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
在密闭容器中有H2、O2、Cl2的混合气体。电火花点燃,容器中的三种气体恰好完全反应,冷却到室温后得到液体产物的溶质质量分数是33.6%,则容器中原H2、O2、Cl2的体积比是
A.2∶1∶1 B.9∶4∶1 C.4∶2∶2 D.9∶4∶3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
已知298K时,Mg(OH)2的溶度积常数为KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中c(H+)=10-13 mol/L
B.所加烧碱溶液的pH=13.0
C.所得溶液中由水电离产生的c(OH-)=10-13 mol/L
D.所得溶液中c(Mg2+)=5.6×10-10 mol/L
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:填空题
某一反应体系中的物质有HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,其中As是产物之一。
(1)写出并配平该反应的化学方程式 ______________
(2)在该反应中,得电子的物质是 (填化学式),被氧化的元素是 (填元素符号);
(3)在该反应中,每转移1 mol电子,消耗(生成)HCl mol;
(4)下列叙述正确的是_____________(填写序号)。
A.在相同条件下,VIIA族元素阴离子的还原性从上到下逐渐增强
B.在反应KIO3 + 6HI = KI + 3I2 + 3H2O中,每生成3mol I2转移的电子数为6NA
C.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-
D.在上述反应中,氧化性:SnCl2 >As还原性:H3AsO3>H2SnCl6
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:选择题
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O7 2-(橙色)+ H2O 2H++ 2CrO42- (黄色)
2H++ 2CrO42- (黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+  2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O72- > Fe3+
C. CrO42- 和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com