
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
| 沸点/℃ | 水溶性 |
甲醇 | 65 | 与水混溶 |
甲醛 | -21 | 与水混溶 |
图15-18是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试完成下列问题:?
?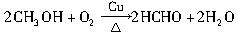
图15-18
(1)若按(甲)装置进行实验,则通入A管的X是 ,B中反应的化学方程式为 。
(2)若按(乙)装置进行实验,则B管中应装 ,反应的化学方程式 。?
(3)C中应装的试剂是 。?
(4)在仪器组装完成后,加试剂前都必须要进行的操作是? ?,若添加药品后,如何检验乙装置的气密性? 。??
(5)两种装置中都需加热的仪器是 (填A、B、C),加热的方式分别为 ,实验完成时,都应先停止对? ?(填A、B、C)加热,再 。若实验完成时先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是? ?。简述工作原理 。
(6)你认为用哪套装置较好 (填“甲”或“乙”),理由是? 。?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2KCl(固体)+H2SO4(浓)![]() K2SO4+2HCl↑,则实验室用该原理制取HCl的发生装置与实验室制 氯气 (填气体名称)相同,将制和HCl气体溶于水即得盐酸,吸收时用倒置的漏斗。现用实验室 O2(以KClO3为原料,MnO2作催化剂)的残渣为原料,先制得HCl,再制取Cl2。
K2SO4+2HCl↑,则实验室用该原理制取HCl的发生装置与实验室制 氯气 (填气体名称)相同,将制和HCl气体溶于水即得盐酸,吸收时用倒置的漏斗。现用实验室 O2(以KClO3为原料,MnO2作催化剂)的残渣为原料,先制得HCl,再制取Cl2。
(1)某学生提出的实验步骤依次是:溶解、蒸发、结晶、制气体。其中还缺少的必要步骤是 ;
(2)某学生开列的实验用品为:烧杯、圆底烧瓶、蒸发皿、量筒、集气瓶、分液漏斗、酒精灯、药匙、托盘天平、铁架台(含铁夹、铁圈)、双孔橡皮塞、玻璃导管、橡皮管、火柴、蒸馏水。所缺少的必要试剂是 ,还缺少的必要的实验用品是 。
(3)写出制得的HCl溶液与MnO2反应制Cl2的离子方程式: 。
(4)甲同学用51.33 g的MnO2和足量浓盐酸共热制取Cl2的质量为m g。乙同学用200 mL 36.5%的浓盐酸(ρ=1.18 g/cm3)和足量的MnO2共热制取Cl2,得到Cl2的质量为n g。砂考虑反应物的损耗的前提下,m与n的大小关系是m n(填>、<、=)。
(5)多余的Cl2吸收的装置中所用的仪器是 ,试剂是 (选填序号:A. NaOH饱和溶液,B. Ca(OH)2饱和溶液),你选择的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
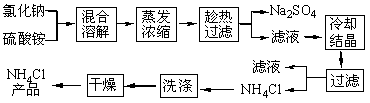

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有_ _、烧杯、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;抽滤所用的滤纸应略_______(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。

图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 ___。某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图2装置,并进行了讨论。
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:__ ____。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.5gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)
。
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案I.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。
方案II.向VmL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色。
方案III,取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg。
①其中不合理的方案是 ,理由是 。
②选择合理方案的数据计算气体Y中SO2的体积分数
(用含未知数的代数式表示) 。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持装置已省略)。
(3)装置A中试剂的作用是 。
(4)简述确认气体Y中含有CO2的实验现象: 。
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠? (填“可靠”或“不可靠”),简述理由: 。

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下表列出了几种物质的物理性质数据,请参考相关物质的数据合成1-溴丁烷。实验室制备1—溴丁烷的反应如下:①NaBr + H2SO4 ?= HBr + NaHSO4 ;②R—OH + HBr ![]() R—Br +H2O可能存在的副反应有:加热过程中反应混合物会呈现黄色或红棕色;醇在浓硫酸存在下脱水生成烯和醚等。请回答下列问题:
R—Br +H2O可能存在的副反应有:加热过程中反应混合物会呈现黄色或红棕色;醇在浓硫酸存在下脱水生成烯和醚等。请回答下列问题:
正丁醇 | 1-溴丁烷 | 正丁醚 | |
熔点/℃ | -89.53 | -112.4 | -98 |
沸点/℃ | 117.7 | 101.6 | 142 |
密度/g.cm-3 | 0.8098 | 1.2758 | 0.769 |
水溶性 | 微溶 | 不溶 | 不溶 |
实验一:实验室制取少量1-溴丁烷的装置如图所示。在a中,加入7.0ml正丁醇、足量的溴化钠和1:1的硫酸。
(1)写出装置图中玻璃仪器的名称:a ▲ ,b ▲ 。
(2)配制体积比1:1的硫酸所用的定量仪器为 ▲ (填字母)。
A.天平 B.量筒 C.容量瓶
(3)制备操作中,加入的浓硫酸必须进行适当的稀释,其目的是 ▲ (填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂

实验二:先利用图甲装置把制备得到的粗产品水洗,水洗时需加入碳酸钠固体加以提纯;再利用图乙装置进行蒸馏提纯。
|
|
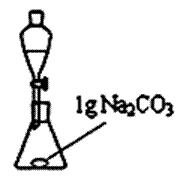
(4)用图甲装置进行水洗提纯时,往往要加入Na2CO3固体,其作用主要是除去 ▲ 。在图乙装置中加入适当的干燥剂,并将洗涤后的粗产品通过分液漏斗转移到图乙装置中进行蒸馏。下列可做为粗产品蒸馏提纯时的干燥剂的是 ▲ 。(填字母)
A.NaOH固体 B.碱石灰 C.无水硫酸钠 D.无水氯化钙
(5)用图乙装置进行蒸馏提纯时,当温度计显示 ▲ 时,收集1-溴丁烷。
(6)若获得了1-溴丁烷为7.0克,试计算其产率 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com