
【题目】反应3X(g)+Y(g)2Z(g)+2W(g)在 2L密闭容器中进行,10 min后 Y减少了1.0 mol,则此反应的平均速率v为
A.v(X)=0.05mol·L-1·min-1B.v(Z)=0.10mol·L-1·min-1
C.v(Y)=0.10mol·L-1·min-1D.v(W)=0.05mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】以烃A为原料合成有机化合物M和N的路线如下:

已知:a.在催化剂作用下,烯烃分子间的双键碳原子可以互换而发生烯烃复分解反应: +
+
![]() 2
2
b.X的苯环上有2种等效氢,且只含1个甲基。
回答下列问题:
(1)根据系统命名法,B的名称是________。N中含氧官能团的名称为________。
(2)M的结构简式是________。
(3)F→G的反应类型是________。
(4)写出C→D的化学方程式________。
(5)同时满足下列两个条件的N的同分异构体共有________种;
①能够发生银镜反应且该物质与生成Ag的物质的量之比为1:4;
②苯环上连接—C5H11。
上述同分异构体中,核磁共振氢谱有5组峰且峰面积之比为9:2:2:2:1的有________和________(写结构简式)
(6)写出以CH2=CH(CH2)4CH=CH2为原料制备![]() 的合成路线________(其他试剂任选)
的合成路线________(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些资料认为NO不能与Na2O2反应,某同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。査阅资料:
a.2NO+Na2O2=2NaNO2;
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O;
某同学用如图所示装置(部分夹持装置略),探究NO与Na2O2的反应。

(1)请写出A中反应的化学方程式___。
(2)B中观察到的主要现象是___。
(3)在反应前,打开弹簧夹,通入一段时间N2,目的是___。
(4)充分反应后,检验D装置中发生反应的实验是___。
(5)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:

①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO![]() ,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为___(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是___。(用化学式回答)
(3)②、⑧两种元素形成的某化合物是一种常见的有机溶剂,写出该化合物的电子式___。
(5)⑦的最简单氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g该氢化物自燃放出45.0kJ的热量(产物为⑦的氧化物和液态水),其热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及离子方程式书写的评价合理的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O===CaSO4↓+Cl-+2H+ | 正确 |
B | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl- | 错误,H+、Cl-的化学计量数应相等 |
C | 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
D | 铝溶于碳酸中:2Al+3H2CO3===2Al3++3H2↑+3CO32- | 正确 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g/mL。
(1)该溶液中NaOH的物质的量浓度为________mol/L。
(2)该溶液中NaOH的质量分数为________。
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为________ mol/L;含NaOH的物质的量为________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如下图,下列说法正确的是
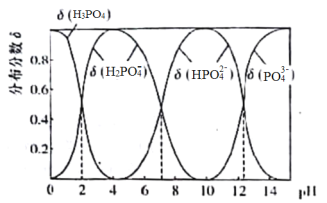
A.滴加NaOH溶液至pH=7,溶液中c(Na+)>c(H2PO4-)+c(HPO42—)+c(PO43—)
B.该温度下,H3PO4的三级电离常数Ka3>10-12
C.H3PO4的电离方程式为:H3PO4 3H+ + PO43—
D.滴加少量Na2CO3溶液,化学反应方程式为3 Na2CO3 + 2H3PO4=2Na2PO4+3H2O+3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com