
【题目】向甲、乙两个恒容密闭容器中分别充入一定量的SiHCl3,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
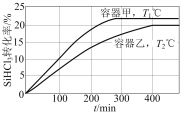
A.T1>T2
B.维持温度不变,向平衡后的乙容器中充入一定量的SiHCl3,平衡不移动
C.T2℃时,反应的平衡常数:K=![]()
D.T1℃时,向甲容器中起始充入0.2molSiHCl3和0.02molSiH2Cl2,SiHCl3的平衡转化率小于10%
【答案】AC
【解析】
A.升高温度,反应速率增大,达到平衡的时间缩短,故T1>T2,A项正确;
B.维持温度不变,向平衡后的乙容器中充入一定量的SiHCl3,平衡正向移动,B项错误;
C.由图可知,T2℃时SiHCl3的平衡转化率是20%,设容器体积为V,初始投SiHCl3xmol,Δn(SiHCl3)=0.2xmol,Δn(SiH2Cl2)=Δn(SiCl4)=0.1xmol,平衡时各物质的量:n(SiHCl3)=0.8xmol,n(SiH2Cl2)=n(SiCl4)=0.1xmol,则K=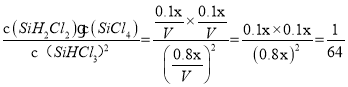 ,C项正确;
,C项正确;
D. 若T2℃时,向乙容器中起始充入0.2molSiHCl3和0.02molSiH2Cl2,当转化率为10%,此时Q<K,反应继续正向移动,达到平衡时转化率高于10%,若相同投量放在甲容器中,由于T1较大,转化率会大于乙装置,大于10%,D项错误;
答案选AC。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
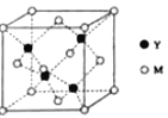
①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAs g·mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
I.下列物质组别中①互为同位素的是_________(填组别选项,下同);②互为同素异形体的是_______;③互为同分异构体的是_________;④属于同一物质的是_________;⑤属于同系物的是_______。
A.冰与水 B.H2、D2、T2 C.O2与 O3 D.![]() 与
与![]() E.CH2CH2CH2CH3 与
E.CH2CH2CH2CH3 与![]() F.
F.![]() 与
与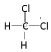 G.甲烷和庚烷
G.甲烷和庚烷
II.(1)乙烯使溴水褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型____(填“相同”或“不相同”)。
(2)用苯制备溴苯的化学方程式是____,该反应的类型____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
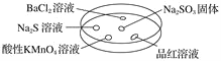
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写均正确的是( )
A.用Cl2与NaOH溶液反应制漂白液:2OH-+Cl2=2ClO-+H2↑
B.SO2通入FeCl3溶液:2Fe3++SO2+2H2O=2Fe2++![]() +4H+
+4H+
C.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3+2Na+
D.H2SO4溶液与Ba(OH)2溶液反应:![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脲醛树脂的合成与酚醛树脂类似,生成线型脲甲醛树脂的方程式为:n![]() +nHCHO
+nHCHO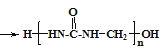 +xH2O,下列说法不正确的是( )
+xH2O,下列说法不正确的是( )
A.网状的脲甲醛树脂以如图所示结构单元为主
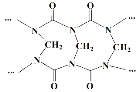
B.方程式中的化学计量数x=n-1
C.脲甲醛树脂合成过程中可能存在中间体![]()
D.通过质谱法测定线型脲甲醛树脂的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠的燃烧产物中混有黑色物质,研究小组进行如图所示的实验探究。下列推测不正确的是( )

A.过氧化钠与硫酸的反应可能有:Na2O2+2H+=2Na++H2O2
B.a试管中的现象说明燃烧前钠块中含有铁元素
C.c试管的溶液为无色,推测发生的反应为:5H2O2+6H++2MnO4-=2Mn2++5O2↑+8H2O
D.根据以上实验可判定:该实验中钠的燃烧产物里含Fe2O3,不含Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是( )

A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的原子不超过10个
C. 1 mol利尿酸能与7 mol H2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com