
| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
分析 (1)用B数据相同的两组,使A数据成倍数关系,即可求出m值(如选编号1、2两组);同样方法求出n值(如选编号1、3两组);将得到的m=1、n=2代入其中一组数据即可求出K,求得m、n、K值;
(2)利用方程式及反应速率表达式即可求出B的初始反应速率.
解答 解:(1)将1、2数据代入v0=kcm(A)cn(B),可得$\frac{{v}_{2}}{{v}_{1}}$=2m=2,m=1,将表中1、3数据代入v0=K{c(A)}m•{c(B)}n可得$\frac{{v}_{3}}{{v}_{1}}$=2n=4,m=2,
将m=1、n=2及数据1代入v0=kcm(A)cn(B)可得:K×1.01×1.02=1.2×10-2,解得K=1.2×10-2L2•mol-2•s-1,
故答案为:1;2;1.2×10-2L2•mol-2•s-1;
(2)当c(A)=c(B)=2.0mol•L-1时,v(C)=(1.2×10-2 L2•mol-2•s-1)×(2.0 mol•L-1)×(2.0 mol•L-1)2=9.6×10-2 mol•L-1•s-1,
以B表示的初始反应速率为9.6×10-2 mol•L-1•s-1×$\frac{3}{2}$=0.144mol•L-1•s-1,
故答案为:0.144mol•L-1•s-1.
点评 本题考查了化学反应速率的计算,题目难度中等.注意熟练掌握化学反应速率的概念及表达式,试题侧重学生的分析、理解能力及灵活应用所学知识的能力的培养.


科目:高中化学 来源: 题型:实验题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
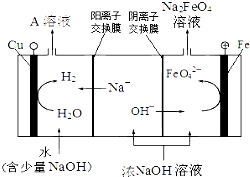
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
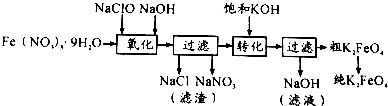
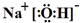 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
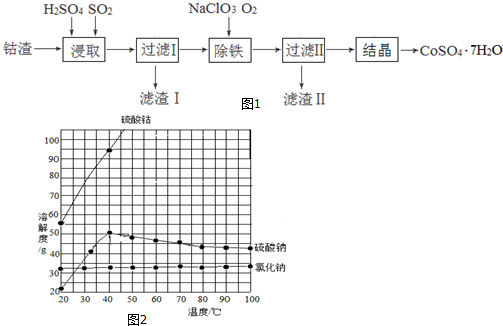
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com