
(6分)(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
② 写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ 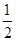 O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
② 写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年湖北省孝感高中高二下学期期末考试化学试题 题型:填空题
(6分)(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
②写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)="==" Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3 + MnSO4 + H2SO4===Na2SO4 + Bi2(SO4)3 + NaMnO4 + H2O
①上述反应中还原产物是 ,若有2mol氧化剂在该反应中被还原,则生成的MnO4-被还原为Mn2+时,能将 molHCl氧化成Cl2;
② 写出NaBiO3固体溶于浓盐酸产生黄绿色气体的化学反应方程式 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(L)===2H2O(L)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+ ![]() O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
O2(g)===H2O(L) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com