
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
分析 (1)①用炭粉在高温条件下还原CuO生成Cu2O和CO2反应的方程式为:C+4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+CO2,还原剂是碳,氧化剂是氧化铜,还原剂与氧化剂的物质的量之比为1:4;
②肼还原新制Cu(0H)2可制备纳米级Cu2O,同时放出N2,结合质量守恒书写方程式;
(2)从价态变化出发分析得失电子总数解答;
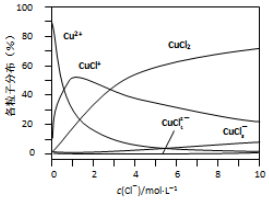
(3)①从图上在c(Cl-)=9mol•L-1处,做一条平行与纵轴的虚线,可以比较;
②从图上在c(Cl-)=1mol•L-1处,做一条平行与纵轴的虚线,看哪种微粒最多;
(4)铜离子水解生成氢氧化铜和氢离子,依据沉淀溶度积常数和溶液中离子积常数计算.
解答 解:(1)①用炭粉在高温条件下还原CuO生成Cu2O和CO2反应的方程式为:C+4CuO$\frac{\underline{\;高温\;}}{\;}$2Cu2O+CO2,还原剂是碳,氧化剂是氧化铜,还原剂与氧化剂的物质的量之比为1:4,故答案为:1:4;
②肼还原新制Cu(0H)2可制备纳米级Cu2O,同时放出N2,则反应的方程式为N2H4+4Cu(OH)2═2Cu2O+N2+6H2O,故答案为:4Cu(OH)2+N2H4=Cu2O+N2↑+6H2O;
(2)从反应4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4分析,Cu从+2价变成+1,4molCu得到4mol电子,H从+1价变成-1价,4mol-1价的H得到8mol电子,共得电子12mol,P从+1价变成+5价,3molP共失电子12mol,每生成4molCuH转移电子12mol,所以,转移电子3mol时应生成CuH1mol,
故答案为:1mol;
(3)①在c(Cl-)=9mol•L-1处,做一条平行与纵轴的虚线,可见溶液中主要含铜物种浓度大小关系为:c(CuCl2)>c(CuCl+)>c(CuCl3-)>c(Cu2+)>c(CuCl42-),
故答案为:c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1mol•L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,加入硝酸银,氯离子浓度下降,方程式为:CuCl++Ag+=Cu2++AgCl↓,故答案为:CuCl++Ag+=Cu2++AgCl↓;
(4)铜离子水解离子反应为Cu2++2H2O?Cu(OH)2+2H+,Ksp=c(Cu2+)×c2(OH-)=2.0×10-20mol3•L-3,则K=$\frac{{c}^{2}({H}^{+})}{c(C{u}^{2+})}$=$\frac{{c}^{2}({H}^{+})×{c}^{2}(O{H}^{-})}{c(C{u}^{2+})×{c}^{2}(O{H}^{-})}$=$\frac{{K}_{w}^{2}}{{K}_{sp}}$=$\frac{(1{0}^{-14})^{2}}{2.0×1{0}^{-20}}$=5×10-9,故答案为:5×10-9.
点评 本题考查氧化还原反应的计算、离子积、化学方程式的书写、图象分析等,侧重考查学生对数据的分析处理能力,难度中等.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
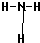 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键. .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. | 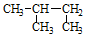 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
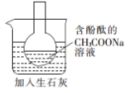 | 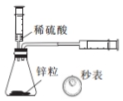 | 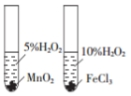 |  |
| 探究温度对盐的水解反应的影响 | 测定一定时间内生成H2的反应速率 | 比较不同催化剂对反应速率的影响 | 量取15.00mL稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
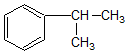
| A. | 它不能使溴水褪色也不能使酸性KMnO4溶液褪色 | |
| B. | 在FeBr3作催化剂时与Br2发生取代反应 | |
| C. | 在一定条件下可发生加成反应 | |
| D. | 一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com