
【题目】(1)下列物质的电离方程式如下:
HClO4=H++ClO4-;
Ba(OH)2=Ba2++2OH-;
Fe2(SO4)3=2Fe3++3SO42-;
KHSO4=K++H++SO42-
属于酸的物质是__________(写化学式);属于碱的物质是__________;属于盐的物质是______________。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是________________________________。
②上述物质中既不是电解质也不是非电解质的是_________________
③写出纯碱的电离方程式:________________________________________________。
【答案】HClO4 Ba(OH)2 Fe2(SO4)3、 KHSO4 纯碱 盐酸 Na2CO3![]() Na++CO32-
Na++CO32-
【解析】
(1)电离出来的阳离子全部是氢离子的化合物为酸,电离出的阴离子全部是氢氧根离子的化合物属于碱,盐是指由金属离子和酸根离子组成的化合物;
(2)①纯碱为Na2CO3,是由金属离子和酸根离子构成的;
②混合物既不是电解质,又不是非电解质;
③纯碱在溶液中完全电离出钠离子与碳酸根离子.
(1)电离出来的阳离子全部是氢离子的化合物为酸,则属于酸的物质为HClO4,电离出的阴离子全部是氢氧根离子的化合物属于碱,则属于碱的物质为Ba(OH)2,盐是指由金属离子和酸根离子组成的化合物,则属于盐的为 Fe2(SO4)3、KHSO4;
(2)①纯碱为Na2CO3,是由金属离子和酸根离子构成的,属于盐,不是碱;
②混合物既不是电解质,又不是非电解质,盐酸是HCl的水溶液,既不是电解质也不是非电解质;
③纯碱在溶液中完全电离出钠离子与碳酸根离子,其电离方程式为:Na2CO3═2Na++CO32-;


科目:高中化学 来源: 题型:
【题目】现有以下反应中,①铁丝在氧气中燃烧 ②加热碳和氧化铜的混合物③碳酸钠和硫酸反应 ④加热高锰酸钾固体 ⑤锌和稀硫酸反应 ⑥硫酸钠溶液和氯化钡溶液混合。属于离子反应的有___________(填各反应的序号,下同),属于氧化还原反应的___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
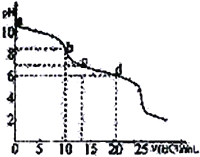
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学物质分类知识,回答下列问题。有下列10种物质
①CH3CH2CH3 ②CH2==CH2 ③![]() ④
④ ![]() ⑤CH3CH2CH2OH ⑥CH3CHO ⑦CuSO4·5H2O ⑧Fe ⑨CH3COOH ⑩CH3COONa
⑤CH3CH2CH2OH ⑥CH3CHO ⑦CuSO4·5H2O ⑧Fe ⑨CH3COOH ⑩CH3COONa
(1)属于无机化合物的是 _______。
(2)属于烃的是_______。
(3)属于烷烃的是______,属于酸的是______。
(4)属于有机化合物的是_______ 。属于烃的衍生物的是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为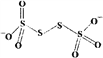 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
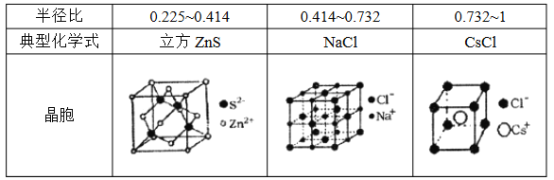
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)![]() 2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A. 用B表示反应速率为0.3 mol·L-1·s-1
B. 平衡后,向容器中充入无关气体(如Ne),反应速率增大
C. 3s时生成C的物质的量为1.2mol
D. 平衡后,v(正)(A)=v(逆)(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在离子化合物中,可能含共价键
B.在共价化合物中,可能含离子键
C.含共价键的化合物一定是共价化合物
D.含离子键的化合物不一定是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com