
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、浓H2SO4有强氧化性,常温下不与Fe、Al发生反应 |
| C、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |


科目:高中化学 来源: 题型:
| A、向试管中加入少量氯乙烷,然后加入NaOH溶液再加热,冷却后加入硝酸银溶液有白色沉淀产生,则说明氯乙烷含有氯元素 |
| B、用分液漏斗分离苯和硝基苯的混合液 |
| C、用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| D、制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、亮菌甲素分子式为C12H11O5 |
| B、亮菌甲素能与三氯化铁溶液发生显色反应,1mol最多能与5mol H2发生加成反应 |
| C、1mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2mol NaOH |
| D、每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧时有浓厚的黑烟 |
| B、实验室制乙炔时可用CuSO4除杂质气体 |
| C、为了减缓电石和水的反应速率,可用饱和食盐水来代替 |
| D、工业上常用乙炔制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
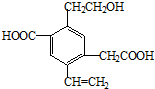
| A、1mol该有机物和过量的金属钠反应最多可以生成1.5mol H2 |
| B、该物质消耗Na、NaOH、NaHCO3的物质的量之比为3:2:2 |
| C、可以用酸性高锰酸钾溶液检验其中的碳碳双键 |
| D、该物质能够在催化剂作用下被氧化为醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | ||
| B、用醋酸除去水垢:CaCO3+2CH3COOH═Ca2++2CH3COO--+H2O+CO2↑ | ||
| C、将丙烯通入溴水中:CH3-CH═CH2+Br2→CH3CHBrCH2Br | ||
D、甲烷与氧气反应:CH4+2O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
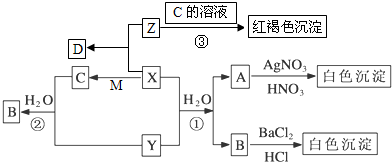
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com