
【题目】下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1b.+29.7 mol·L-1
c.-20.6 mol·L-1d.-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用情性电极电解100ml0.5mol/L的CuSO4溶液、当阳极产生1.12L(标准状况)气体时,若要使电解质溶液恢复到电解前的状态,需加入的物质是( )
A. CuCO3B. CuOC. Cu(OH)2D. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜铁及其化合物在日常生活和工业生产中有着重要用途。
(1)铁制炊具在潮湿的空气中易发生吸氧腐蚀而生锈,负极的电极反应式为:___,正极的电极反应式为:___。
(2)下列哪些装置可防止铁棒被腐蚀___。(填正确答案标号)
A.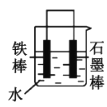 B.
B.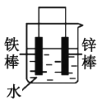 C.
C.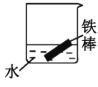 D.
D.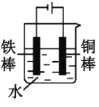
(3)高铁酸钾(K2FeO4)广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如图:
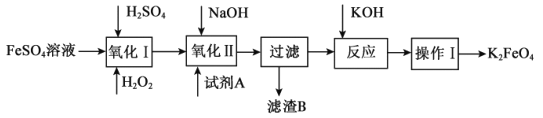
查阅资料:K2FeO4在水中溶解度很大,在碱性环境中稳定,在中性和酸性条件下不稳定。
①“氧化I”中,生成Fe3+的离子反应方程式是___。
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4+ H2O= Fe(OH)3↓+ KOH+ 。___。
(4)工业上常以铜做阳极,石墨做阴极,电解含有NaOH的NaCl水溶液制备Cu2O。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式___,该过程中生成Cu2O的离子反应方程式为___。
②如果电解后溶液体积未发生变化,电解后溶液中的c(OH-)会___(填“变大”“变小”或“不变”)。
③若电解时电路中通过0.2mol电子,理论上生成Cu2O的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使酚酞变红的溶液:Na+、Al3+、SO42-、NO3-
B.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
C.0.1 mol·L-1Na2SO3溶液:NH4+、K+、ClO-、Cl-
D.0.1 mol·L-1 FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y是一种药物中间体,可由X制得:
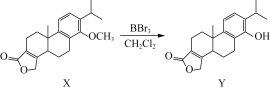
下列有关化合物X、Y的说法正确的是( )
A.Y分子中五元环上的4个碳原子一定共平面
B.1 mol X最多能与2 mol Br2反应
C.用FeCl3溶液可鉴别化合物X和Y
D.X、Y在酸性条件下的水解产物均能发生氧化反应、加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以扑热息痛(对乙酰氨基苯酚)为原料,经多步反应制甘素的流程如下:
AcHNOH扑热息痛![]() 非那西汀
非那西汀![]() …
…![]() 甘素
甘素

步骤Ⅰ:非那西汀的合成
①将含有1.0 g扑热息痛的药片捣碎,转移至双颈烧瓶中。用滴管加入8 mL 1 mol/LNaOH的95%乙醇溶液。开启冷凝水,随后将烧瓶浸入油浴锅。搅拌,达沸点后继续回流15 min。
②将烧瓶移出油浴。如图所示,用注射器取1.0 mL的碘乙烷,逐滴加入热溶液中。继续将烧瓶置于油浴回流15 min。
③将烧瓶从油浴中抬起,取下冷凝管趁热用砂芯漏斗抽滤,滤去不溶的淀粉(药片的填充物)。将热滤液静置,得到沉淀。用另一个砂芯漏斗过滤得到非那西汀固体。
步骤Ⅱ:甘素的合成
①将非那西汀固体转移到圆底烧瓶中,加入5 mL 6 mol/L盐酸。加热回流15 min。
②加入NaHCO3调至pH为6.0~6.5,再向反应液中加1.37 g尿素和2滴乙酸。加热回流60 min。
③移出烧瓶,冷却,有沉淀析出,抽滤,用冰水洗涤,得到甘素。
(1)将药片捣碎所用的仪器名称为________________。
(2)实验中用油浴加热的优点是______________________。
(3)使用砂芯漏斗抽滤的优点是_________________且得到的沉淀较干燥。
(4)冷凝管的冷却水从________(填“a”或“b”)端进。
(5)步骤Ⅱ中向热溶液中加入NaHCO3中和,为避免大量CO2逸出,加入NaHCO3时应__________________。
(6)用冰水洗涤甘素固体的操作是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用B、C、D表示的反应速率其比值是3:2:1
C. 在2min末的反应速率,用B表示是0.3mol/(L·min)
D. 在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com