
���� ������Ŀ��������Ϣ����ȡ���������ĩ�ӵ�����ˮ�У��õ���ɫ��Һ�����ų�CuSO4��ͬʱ����BaCl2��Na2CO3��K2SO4�����棬��ȷ������BaCl2���ڣ����ų����ߣ���֮��BaCl2�����ڣ���ȡ������Һ�������������м�������ϡ���ᣬ�����ݲ�������֪���ɵ�����Ϊ������̼��ȷ����Һ����Na2CO3���ų�BaCl2�Ĵ��ڣ��ۼ�������е���Һ�μ�Ba��NO3��2��Һ���а�ɫ�������ɣ��˳���ΪBaSO4������ȷ��ԭ�������K2SO4��ԭ��ʵ������������ữ������SO42-����ȡ������Һ����������NaOH��Һ�����ȣ������̼�����ζ�����壬����ʪ��ĺ�ɫʯ����ֽ�������壬��ֽ��������֪���ɵ�����ΪNH3��ȷ����Һ����NH4+������NH4Cl���ݴ˷�����֪��ԭ�������һ����NH4Cl��Na2CO3��һ��û��CuSO4��BaCl2��������K2SO4��
��� �⣺��1����ʵ��ڿ�֪��������Na2CO3��ʵ��ܿ�֪��������NH4Cl���ʴ�Ϊ��NH4Cl��Na2CO3��
��2����ʵ����ų���CuSO4������Na2CO3�ų�BaCl2���ʴ�Ϊ��CuSO4��BaCl2��
��3����ȷ������K2SO4����������ɫ��Ӧ���ܹ�SO42-�ļ��飬ȷ���Ƿ���ڣ��������Ϊ���ýྻ��˿պȡ����������Һ�������գ�����ɫ�ܲ����۲쵽�������ɫ��˵����K2SO4������û�У� ����ȡ������Һ�������ữ���������ɣ��ټ�������BaCl2��Һ���а�ɫ�������ɣ�˵��ԭ��Ʒ����K2SO4������û�У��ʴ�Ϊ���ýྻ��˿պȡ����������Һ�������գ�����ɫ�ܲ����۲쵽�������ɫ��˵����K2SO4������û�У� ����ȡ������Һ�������ữ���������ɣ��ټ�������BaCl2��Һ���а�ɫ�������ɣ�˵��ԭ��Ʒ����K2SO4������û�У�
��4��ʵ����в����̼�����ζ���巴Ӧ�Ļ�ѧ����ʽΪNH4Cl+Na OH$\frac{\underline{\;\;��\;\;}}{\;}$Na Cl+NH3��+H2O���ʴ�Ϊ��NH4Cl+Na OH$\frac{\underline{\;\;��\;\;}}{\;}$Na Cl+NH3��+H2O��
���� ���������ƶ��⣬�������������͵��ƶ��⣬��ͨ����ʵ�鷽�����̵�̽�����ڱȽϼ���Ļ����ϣ��ó�����ȷ��ʵ����ۣ����������п�����Ҫ����֮һ��Ҫ��ϸ���⣬������գ��˿�����Ҫ������������ʵ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
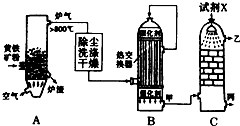 �ϳɰ���ҵ�����Ṥҵ�����Ṥҵ�ǻ�ѧ��ҵ����Ҫ��ɲ��֣���ش��������⣺
�ϳɰ���ҵ�����Ṥҵ�����Ṥҵ�ǻ�ѧ��ҵ����Ҫ��ɲ��֣���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.3 mol/L | B�� | 0.03 mol/L | C�� | 0.05 mol/L | D�� | 0.04 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۳� | B�� | �����ЧӦ | C�� | �����˶� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ұ��������ͨ���õ���Ȼ�����Һ�ķ��� | |
| B�� | Ҫʹ��ˮ����ͨ�����������ӽ����� | |
| C�� | ������������������Ư�� | |
| D�� | ��ҵұ�����������������������������·������ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2O ��g���TH2��g��+$\frac{1}{2}$O2��g������H�T-485 kJ/mol | B�� | 2H2��g��+O2��g���T2H2O��g������H�T-485 kJ/mol | ||
| C�� | 2H2��g��+O2 ��g���T2H2O��g������H�T+485 kJ/mol | D�� | H2O ��g���TH2��g��+$\frac{1}{2}$O2��g������H�T+485 kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com