
1L某混合溶液中,溶质X、Y的浓度都为0.1mol?L﹣1,向混合溶液中滴加某溶液Z(0.1mol?L﹣1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是( )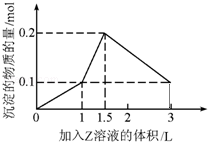
| A.氯化铝、氯化铁、氢氧化钠 | B.氯化铝、氯化镁、氢氧化钠 |
| C.偏铝酸钠、氢氧化钡、硫酸 | D.偏铝酸钠、氯化钡、硫酸 |
C.
解析试题分析:从图象趋势和沉淀于消耗Z的量,可知溶液中有偏铝酸钠,无铝盐溶液,故所加Z为硫酸溶液,从生成沉淀质量增加知含Ba2+;故AB错误;若为偏铝酸钠、氯化钡、硫酸,开始滴入硫酸时会生成沉淀氢氧化铝和硫酸钡沉淀,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.1mol,需要硫酸0.1mol,同时生成盐酸氯化氢0.2mol,所以溶液不能为中性,并且不符合第一个拐点,故D不符合;按图象拐点分成三个阶段,1、硫酸和氢氧化钡分别是二元强酸强碱,因此一开始氢氧化钡的OH﹣和硫酸里的H+1:1中和.同时Ba2+和SO42﹣,1:1反应生成硫酸钡沉淀;2、氢氧化钡消耗完,硫酸继续滴加,氢离子开始和偏铝酸根离子反应生成氢氧化铝沉淀,由于H+和AlO2﹣是1:1反应,但硫酸是两元酸,因此硫酸的消耗量和沉淀的生成量是1:2;3、硫酸进一步过量,开始消耗沉淀,3份H+消耗一份Al(OH)3,因此硫酸和沉淀消耗量应为1.5:1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4.符合图象的数值变化;故C符合;
考点:镁、铝的重要化合物.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
现有铝和过氧化钠的固体混合物样品,加入稀盐酸使混合物完全溶解,所得溶液c(Al3+)∶c(H+)∶c(Cl-)=1∶2∶8,则原固体混合物中铝元素与氧元素的质量比为( )
| A.3∶4 | B.9∶32 | C.9∶16 | D.9∶8 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在由Fe、FeO、和Fe2O3组成的混合物中加入100 mL2 mol ·L—1的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是
| A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1︰1︰3 |
| B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为2︰1 |
| C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 |
| D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/L的NaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是: ( )
| A.200mL | B.250ml | C.425mL | D.560mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2.3g钠投入100g水中,下列叙述述错误的是
| A.钠浮在水面,熔化成银色光亮的小球 | B.钠贮存在煤油中 |
| C.所得溶液的质量分数为2.25﹪ | D.反应中转移0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出相同体积的气体,则两份铝粉的质量比为( )
| A.1:1 | B.2:3 | C.3:2 | D.1:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com