
【题目】NiSO4、NiCl2是制取高纯镍和电镀行业的重要原料,回答下列问题:
(1)碱性条件下利用肼(N2H2)还原NiCl2溶液可生成高纯Ni纳米粒子和某气体单质,写出反应的离子方程式_________________________________。温度对反应时间和Ni粒径的影响如图所示,温度为___________(选填字母)℃时,很难形成纳米级别的Ni(已知纳米级别的Ni与胶体分散质的大小一致)。
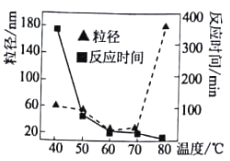
A.43 B.50 C.64 D.79
(2)利用某含镍废料(主要成分为Ni,还含有铝、铁的氧化物)可制备硫酸镍晶体(NiSO4·7H2O),其流程如图所示:

已知:Ksp[Ni(OH)2]=2.0×10-15 K sp[Fe(OH)2]=8.0×10-16
K sp[Fe(OH)3]=4.0×10-38
①写出“氧化”步骤中发生反应的化学方程式_________________________________,步骤需要控制温度40℃左右,其目的是_________________________________。
②已知“酸浸”所得滤液中c(Ni2+)=1mol/L,c(Fe2+)=0.1mol/L,试通过计算证明“氧化”步骤的必要性__________________________________________________________________(离子浓度小于1×10-5mol/L时可认为沉淀完全,要有计算过程和合理的文字叙述)。
③“系列操作”包括__________、冷却结晶、过滤、乙醇洗涤、干燥等操作,其中利用乙醇洗涤硫酸镍晶体的优点是____________________________________________。
【答案】N2H2+2Ni2++ 4OH-==2 Ni+N2↑+ 4H2O D 2FeSO4+H2O2+H2SO4==Fe2(SO4)3+2H2O 加快反应速率,防止温度过高H2O2分解 Fe2+恰好沉淀完全时, ![]() ,此时
,此时![]() ,因此若无“氧化”步骤,当Fe2+恰好沉淀完全时,Ni2+也会生成沉淀 蒸发浓缩 减少硫酸镍晶体因溶解而造成的损失,更有利于硫酸镍晶体的干燥
,因此若无“氧化”步骤,当Fe2+恰好沉淀完全时,Ni2+也会生成沉淀 蒸发浓缩 减少硫酸镍晶体因溶解而造成的损失,更有利于硫酸镍晶体的干燥
【解析】
本题以Ni的化工流程为线索,考查了陌生氧化还原方程式的书写、Ksp的相关计算、控制反应温度的目的和制取晶体的实验操作规范等知识点。
(1)由题意Ni化合价下降,则N化合价升高,所以单质为N2,故离子反应方程式为N2H2+2Ni2++ 4OH-== 2Ni+N2↑+ 4H2O;胶体粒径范围为1-100nm,由图中信息可知,当温度在79℃左右时,粒径大于100nm,难以形成纳米级别的Ni,故选D。
(2)①原料中含有铁的氧化物,可能含有Fe2+,双氧水可将其氧化为Fe3+,对应方程式为2FeSO4+H2O2+H2SO4==Fe2(SO4)3+2H2O;温度过低时,反应速率过慢,温度过高时,双氧水易分解。故实际控制温度40℃左右,其目的是:既可以加快反应速率,也可以防止温度过高H2O2分解;
②Fe2+恰好沉淀完全时,![]() ,此时
,此时![]() ,因此若无“氧化”步骤,当Fe2+恰好沉淀完全时,Ni2+也会生成沉淀;
,因此若无“氧化”步骤,当Fe2+恰好沉淀完全时,Ni2+也会生成沉淀;
③从滤液中获取晶体常见操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,利用乙醇洗涤可减少硫酸镍晶体因溶解而造成的损失,更有利于硫酸镍晶体的干燥。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 离子半径:X<Y<Z<W
D. 含W的盐溶液可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是
A.l0g H2和l0g O2B.9g H2O和0.5mol Br2
C.224mL H2(标准状况)和0.1mol N2D.5.6L N2(标准状况)和22g CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A. 甲醇 B. 天然气 C. 液化石油气 D. 氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—E五种物质都含有同一种元素,它们之间的转化关系如图所示,其中A为淡黄色固体化合物,B为单质。

(1)固体A的名称为____,单质B的常见用途有:_____(任写一条)。
(2)写出下列反应的化学方程式
①B→C__________
②A→D__________
(3)写出将氯气通入C溶液中的化学方程式_____,其溶液有漂白作用,漂白原理是______。(写反应方程式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com